禽流感(avian influenza,AI)是由正黏病毒科A型禽流感病毒(avian influenza virus,AIV)引起的禽类传染病[1]。该病主要经呼吸道传播,通过密切接触感染的禽类及其分泌物、排泄物、受病毒污染的水源,以及直接接触病毒等方式感染。禽流感按毒力和致病性可分为低致病性禽流感(LPAI)和高致病性禽流感(HPAI)2种类型。低致病性禽流感致死率较低,主要引起不同程度的呼吸道及消化道症状,造成产蛋率下降。高致病性禽流感传播快、危害大及致死率高。目前已发现有18种HA(H1~H18)亚型和11种NA(N1~N11)亚型。在世界范围内家禽主要流行H5、H6、H7和H9等亚型,其中H5和H7亚型毒株被称为高致病性禽流感病毒。世界动物卫生组织(OIE)将高致病性禽流感列为法定报告动物疫病,我国也将其列为一类动物疫病[2]。1878年在意大利鸡群中禽流感首次暴发,1955年Shafer证实该病是由A型禽流感病毒引起的,1997年在香港发现首例禽流感感染人事件,至今为止许多国家和地区均暴发过禽流感。因其对养禽业造成的严重打击和能跨种间传播感染人类,所以禽流感的诊断和防控尤为重要。一般禽流感诊断方式包括临床诊断和常规实验室诊断,然而流感病毒亚型众多,毒力差别大,症状千差万别,单靠临床诊断难以确诊,常规实验室诊断亦无法完全满足快速、准确和高效的诊断要求。随着近年来分子生物学技术的飞速发展,更加准确快速的检测方法大大提高了动物病原的诊断水平。目前禽流感病毒的核酸分子检测方法,主要有常规RT-PCR、荧光定量RT-PCR、微滴数字PCR技术、环介导等温扩增及重组酶聚合酶扩增技术5种方法。
1、基于聚合酶链式反应技术(Polymerase Chain Reaction,PCR)
PCR指在引物指导下由酶催化的对特定模板的扩增反应,是模拟体内DNA的复制过程,在体外特异性扩增DNA片段的一种技术。PCR技术敏感性高、操作简便、快速高效和应用广泛,既可做病原体的检测,又可同时进行不同病原或同一病原不同株的检测。目前以常规PCR作为基础,演变出如巢式PCR、反转录PCR、荧光定量PCR和数字PCR等技术,以下就其中3种技术的特点及针对不同亚型的应用进行归纳。
1.1反转录PCR技术(reverse transcription PCR,RT-PCR)
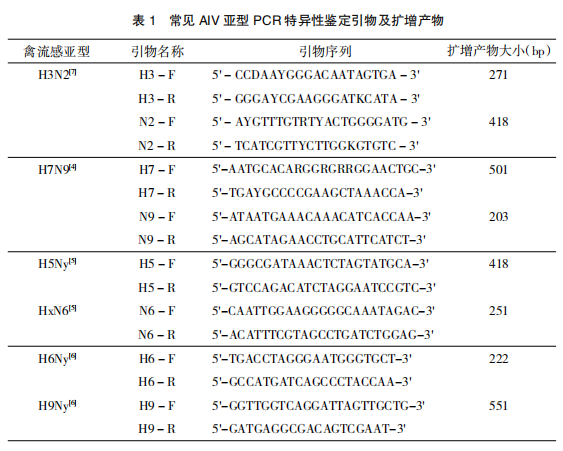
RT-PCR是基于基因水平的诊断,是禽流感早期快速诊断技术之一。RT-PCR将来自于鸡胚、细胞培养液或者临床诊断组织样品的病毒RNA反向转录成cDNA,然后使用禽流感病毒特异性引物扩增该cDNA[3],用琼脂糖凝胶分离PCR产物,再使用溴化乙锭染色分析。通过设定特定HA及NA保守序列,可对主要流行的AIVH5、H6、H7和H9等亚型进行检测,结果显示具有较高的特异性,能根据所检测亚型AIV特异性目的条带与其他亚型AIV和NDV、IBV等无特异性条带的其他禽病病原相区分[4~6]、[8]。Bao-Feng Qiu[9]等根据GenBank中AIVNA序列设计了9对特征引物,建立了对NA进行灵敏、快速区分AIVNA亚型的RT-PCR法,比对结果表明该RT-PCR法的灵敏度为97.3%。RT-PCR检测方法具有特异性强、敏感性高、稳定性和重复性良好的优点,现广泛应用于实验室检测,其主要缺点是需要进行凝胶电泳与凝胶成像等复杂的操作,操作过程中可能产生污染,污染试验环境可能造成假阳性结果。因此常规RT-PCR检测需要注意控制好环境污染问题,要及时清理PCR产物和电泳后的废胶,避免污染。表1[4~7]为目前常见AIV亚型PCR特异性鉴定引物序列及扩增产物大小。
1.2荧光定量PCR技术(quantitative real-time PCR,qPCR)
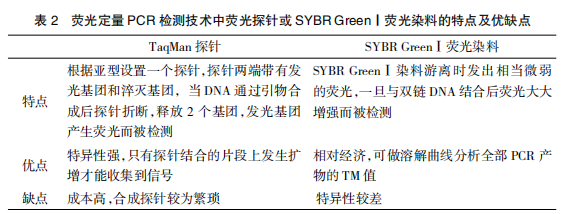
荧光定量PCR检测技术是指采用荧光探针或SYBRGreenⅠ荧光染料通过实时检测PCR扩增反应中每个循环产物荧光信号强弱变化从而实现对起始模板定量及定性的分析。荧光定量PCR是目前确定样品中核酸拷贝数目最敏感和最准确的方法,其灵敏度为10~100个拷贝数,为普通PCR的10~1000倍[10、11]。对2种常用方法进行比较,优缺点如表2。
荧光定量PCR技术是近年来应用较多的分子生物学检测技术,可对禽流感病毒的亚型进行区分,主要用于检测低致病性AIVH1、H3、H4、H6和H9等亚型。应用该方法检测H9亚型AIV灵敏度比RT-PCR高出104倍[12]。为同时检测H5、H7和H9禽流感病毒,Monne[13]等首次建立了一步法实时反转录PCR(real-time re-verse transcription-PCR,RRT-PCR)检测,目前Junli Liu[14]等也开发了三重荧光定量PCR技术用于同时检测。目前荧光定量PCR已经在省级以上动物疫病诊断机构广泛使用。该检测方法以定量准确为优势,融合了传统PCR方便快速、DNA杂交的高特异性和光谱技术的高敏感性和高精确定量等特点[15],相对常规PCR的优势在于:所需时间较短,自动化程度高,无需凝胶电泳与凝胶成像等后续操作,彻底杜绝了PCR产物的气溶胶污染和溴化乙锭(EB)对环境的污染。
1.3数字PCR技术数字PCR(digitalPCR,dPCR)
技术作为一种全新的核酸检测方法,通过把反应体系均分到大量反应单元中独立地进行PCR,并根据泊松分布和阳性比例来计算核酸数量[16]。目前数字PCR可分为两大类:微滴数字PCR系统和微流控芯片数字PCR系统。
1.3.1微滴数字PCR技术(droplet digital PCR,ddPCR)
ddPCR技术是在传统的PCR扩增前将一个大的反应体系进行微滴化处理,即利用油包水技术将其“分割”为数万个纳升级的微滴,每1个微滴都是1个独立的PCR反应体系。BinWu[17]等建立了微滴数字RT-PCR方法检测LPAI H9亚型,可检测到痕量H9 AIV,具有良好的特异性,且其灵敏度优于real-time RT-PCR。在人类感染禽流感病毒的临床治疗过程中也可利用反转录微滴数字PCR进行动态量化以监测抗病毒的治疗效果,比对结果表明RT-ddPCR比real-timeRT-PCR具有更高的敏感性,并可以在不使用标准曲线的情况下对H7N9病毒载量进行量化[18]。冯兆民[19]等建立了基于微滴式dPCR的FluA绝对定量方法,可有效地对临床样本中甲型流感病毒载量进行绝对定量。微滴数字PCR技术操作过程中要尽量避免反应准备、液滴生成、目标放大和液滴读数等步骤之间的试剂转移影响结果[18]。另外,阈值线的设置可能会引起结果的偏倚[19]。
1.3.2微流控芯片数字PCR技术(chip digitalPCR)
为了改善常规基因检测操作繁琐、自动化程度低、速度慢的缺点,研究者们将热循环仪和PCR芯片研发成芯片PCR,将反应时间缩短为几十分钟至几十秒,实现了基因分析的多步骤集成[20]。微流控芯片数字PCR技术是在微流体技术、纳米制造技术和微电子技术等大力发展的基础上产生的,通过微流控芯片技术可使样品流体快速准确地分布于若干个独立单元[21]。王伟[22]利用微流控芯片技术对AIV H5、H7和H9亚型进行快速检测,证实微流控PCR技术快速、准确和可靠。微流控PCR芯片的形式从最初单个微池或是简单的蛇形通道逐渐变得越来越丰富,功能也越来越完善。目前的微流控芯片PCR技术中,荧光检测是最为便捷和灵敏的检测手段,但是所需的光学仪器和摄像设备较为昂贵;毛细管电泳与凝胶电泳相对廉价但是受到精度和灵敏度的限制;离线检测耗时耗力且容易引入污染。因此发展一种能够在线检测,且低成本、高速度及高通量的检测方法将是今后研究者的研究重点[23]。
使用dPCR技术的优点[16,18,21]在于:①适用于低丰度样本的检测,珍贵样本或核酸存在降解的样本扩增及稀有突变检测。②与传统PCR、定量PCR相比,其结果的精确度、准确性和灵敏度更高。③dPCR直接计算目的序列的拷贝数,无需依赖于放大曲线的循环阈值(Ct值)和标准曲线,实现真正意义上的绝对定量检测。④无需阳性对照便可得出结果,可避免实验中阳性对照污染;在对每个反应单元进行结果判读时仅判断阳性/阴性两种状态,可显著地降低各反应单元中背景序列和抑制物对反应的干扰。但是dPCR技术不适用于量化高丰度样本,超出样本检测范围需将样本稀释后再进行检测。
2、环介导等温扩增反应(LAMP)
于2000年诞生的环介导等温扩增反应技术是分子检测技术的又一突破,该反应只需将基因模板、4条特异性引物(由内引物FIP、BIP及外引物F3、B3组成)、链置换型DNA合成酶、基质等共同置于恒温下(60~65℃),经1个步骤即可完成对核酸的扩增[24]。其扩增效率极高,可在15~60min内实现109~1010倍的扩增[25]。而且由于LAMP具有高度的特异性,只需根据扩增反应产物的有无即可对靶基因序列的存在与否作出判断。LAMP扩增结果的检测方法一般有以下4种[26~27]:①肉眼观察法:LAMP反应过程中,在核酸大量生成的同时也随之产生衍生物,从dNTPS中析出的焦磷酸根离子和反应液中的Mg2+结合,产生肉眼可见的白色焦磷酸镁沉淀。②琼脂糖凝胶电泳的检测方法:由于LAMP的反应产物为大小不一的DNA片段,因此其扩增产物在凝胶成像系统下呈现典型的梯形条带。③荧光检测法:SYBR GreenⅠ是高灵敏的DNA荧光染料,不扩增时管内液体为橙红色,一旦与双链DNA高结合亲和力便会产生在紫外灯可见的绿色荧光信号。可参照相对保守的基质蛋白(M)基因以结合SYBR GreenⅠ,特异性检验H5和N9亚型AIV[28]。④浊度仪:利用LAMP反应中焦磷酸镁沉淀(在400nm处有吸收峰)与所合成DNA量之间的线性关系,通过实时浊度仪监测沉淀的形成量,对反应中DNA的合成量进行反推,从而对LAMP可进行实时监测和定量,可用于H7和N9亚型AIV的检测[29]。另外,针对RNA病毒检测,在LAMP反应体系中加入反转录酶,直接以RNA作为检测模板,在等温条件下同时进行反转录和LAMP扩增,一步完成RT-LAMP的检测[30、31]。RT-LAMP也可应用于冻干处理的AIV检测[32]。LAMP法与传统的PCR法相比技术操作更为简便,不需要使双链DNA先变性成单链,并且扩增的效率极高,灵敏度比传统PCR检测高。LAMP检测技术对AIV16个HA亚型均可以检测,具有较好的特异性,灵敏度为普通RT-PCR方法的10倍[33]。LAMP检测不需要特殊的仪器,仅用水浴锅或恒温箱即可持续进行扩增反应,可推广于基层部门使用。LAMP技术缺点是[25]对引物设计要求较高,扩增目的片段大小只能限制于200bp,利用荧光染料检测扩增结果时打开PCR管加入SYBR GreenI观察颜色反应,开盖容易形成气溶胶污染出现假阳性问题。
3、重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)
RPA是Piepenburg[34]等于2006年建立的新型核酸扩增技术,是通过寡核苷酸引物、与模板DNA的结合和DNA聚合酶的延长来实现特定DNA片段的等温扩增。RPA技术的优点[35、36]在于:①在等温反应下即可进行,最适温度在37~42℃。②反应速度快,30min以内可完成扩增,且无需变性。③无需昂贵的仪器设备,仅用简易保温装置即可进行反应,成本低廉,且相较于LAMP更加快速准确,引物设计更简单。④灵敏度比传统PCR高10~102倍,特异性强。缺点是[35]在目的DNA含量较低的情况下,偶尔会产生非特异性的产物,也有可能因为反应温度较低而出现序列不匹配的产物。RPA技术以其快捷准确、设备简单和能应用于现场检验等优点迅猛发展,现已应用于许多细菌、病毒、寄生虫、立克次氏体和衣原体等病原微生物的检测中[36~39]。Nahed Yehia[40]等建立了检测H5N1亚型禽流感HA基因的RT-qRPA方法。该方法在7分钟内检测到一种RNA分子,在平行检测30份样品中灵敏度和实时RT-PCR一致。
4、小结与展望
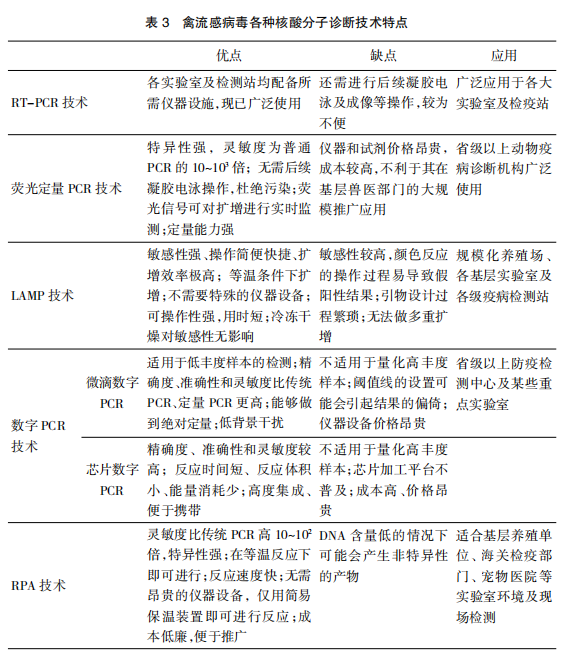
上述各种技术均是目前检测禽流感病毒的常用方法,具有特异性强、敏感性高和方便快捷的优点(表3)。目前RT-PCR诊断已广泛应用于各大实验室及检疫站,而后续需要做凝胶电泳验证,可能发生污染而出现假阳性结果。荧光定量PCR技术则弥补了常规PCR方法的缺点,无需凝胶电泳,杜绝了污染,但由于所用仪器和试剂价格昂贵,成本较高,不利于其在基层兽医部门的大规模推广应用。LAMP方法不需要特殊的仪器设备,操作简便,但引物设计过程繁琐,由于敏感性较高,颜色反应的操作过程易导致假阳性结果。数字PCR和RPA是新兴的检测方法,数字PCR更适用于低丰度样本的检测,灵敏度高、准确性好,能够做到绝对定量检测;RPA成本低廉、反应快速,可适用于各养殖场、检疫单位及宠物医院,但可能会产生非特异性的产物。因此,禽流感的诊断仅单独使用其中某一种方法难以确诊,应将各种方法结合起来综合判断。为做好对禽流感的防治工作,秉承严谨科学的原则,各单位应根据不同的条件,选择适合的方法。
参考文献
[1]Chaharaein B, Omar A R, Aini I, et al. Detection of H5, H7 and H9 subtypes of avian influenza viruses by multiplex reverse transcription-polymerase chain reaction. Microbiological Research, 2009, 164(2):174-179.
[2]甘孟侯. 禽流感[M]. 2 版.北京: 北京农业大 学出版社, 1995 .
[3]Yogesh Chander,Naresh Jindal,David E. Stallknecht,et al. Full length sequencing of all nine subtypes of the neuraminidase gene of influenza A viruses using subtype specific primer sets[J]. Journal of Virological Methods,2010,165(1).
[4]王云鹤,包红梅,孙佳善,等.H7N9 亚型禽流 感病毒 RT-PCR 检测方法建立 [J]. 中国农业科 学,2015,48(15):3050-3055.
[5]何莹,谢芝勋,罗思思,等. H5 亚型和 N6 亚 型禽流感病毒二重 RT-PCR 检测方法的建立 [J]. 动物医学进展,2017,38(03):1-4.
[6]李丹,谢芝勋,宋德贵,等. H9 和 H6 亚型禽 流感病毒二重 RT-PCR 检测方法的建立 [J]. 中 国畜牧兽医,2016,43(12):3101-3106.
[7]刘婷婷,谢芝勋,宋德贵,等.H3N2 亚型禽流 感病毒二重 RT-PCR 检测方法的建立[J].黑龙 江畜牧兽医,2015(13):172-174.
[8]Yan-di WEI,Wei-hua GAO,Hong-lei SUN,et al. A duplex RT-PCR assay for detection of H9 subtype avian influenza viruses and infectious bronchitis viruses[J]. Journal of Integrative Agriculture,2016,15(9).
[9]Bao-Feng Qiu,Wu-Jie Liu,Da-Xin Peng, Shun-Lin Hu,Ying-Hua Tang,Xiu-Fan Liu. A reverse transcription-PCR for subtyping of the neuraminidase of avian influenza viruses [J]. Journal of Virological Methods,2008,155(2).
[10]罗思思,谢芝勋,谢志勤,等. H6N1 亚型禽 流感病毒二重荧光 RT-PCR 检测方法的建立 [J]. 中国畜牧兽医,2016,43(02):326-332.
[11]申伟霞,田巧珍,陈圆,等. H3、H9 亚型禽 流感病毒双重荧光定量 PCR 方法的建立及初 步应用[J]. 中国动物传染病学报,2014,22(01): 16-24.
[12]M. Ben Shabat,R. Meir,R. Haddas,et al. Development of a real-time TaqMan RT-PCR assay for the detection of H9N2 avian influenza viruses[J]. Journal of Virological Methods,2010,168(1).
[13]Monne Isabella,Ormelli Silvia,Salviato Annalisa,et al. Development and validation of a one-step real-time PCR assay for simultaneous detection of subtype H5, H7, and H9 avian influenza viruses.[J]. Journal of Clinical Microbiology,2008,46(5).
[14]Junli Liu,Lu Yao,Feifei Zhai,et al. Development and application of a triplex real-time PCR assay for the simultaneous detection of avian influenza virus subtype H5, H7 and H9 [J]. Journal of Virological Methods,2017.
[15]田莉莉,李丽.荧光定量 PCR 技术在禽病诊 断中的应用 [J]. 中国农学通报,2012,28(14): 1-5.
[16]詹成,燕丽,王琳,等.数字 PCR 技术的发展 和应用 [J]. 复旦学报 (医学版),2015,42(06): 786-789.
[17]Bin Wu,Lin Zhang,Liming Su,et al. Establishment and Application of Digital RT-PCR Assay for Detection of Avian Influenza Virus H9 Subtype[J]. Advances in Microbiology,2017,07(11).
[18]Yong Yan,Xiao-jun Jia,Heng-hui Wang,et al. Dynamic quantification of avian influenza H7N9(A) virus in a human infection during clinical treatment using droplet digital PCR [J]. Journal of Virological Methods,2016,234.
[19]冯兆民,赵翔,邹晓辉,等.基于微滴式数字 PCR 技术的甲型流感病毒绝对定量方法的建立 及应用[J].病毒学报,2017,33(01):1-5.
[20]刘铁牛.芯片 PCR 及其应用[J].国际医药卫 生导报,2004(18):214-215.
[21]赵治国,崔强,赵林立,等.微滴数字 PCR 技 术应用进展 [J]. 中国生物工程杂志,2017,37 (06):93-96.
[22]王伟. 微流控芯片技术对禽流感病毒的快 速检测[D].山东农业大学,2010.
[23]何启迪,黄丹萍,黄冠,等.微流控 PCR 芯片 的 研 究 进 展 [J]. 分 析 化 学 ,2016,44(04): 542-550.
[24]吴禹熹,李璞君,王娟,等.LAMP 方法及其 在病原微生物检测中的应用[J].中国畜牧兽医, 2016,43(02):389-393.
[25]黄思佳,解庭,严家新. 环介导等温扩增反 应的原理及应用 [J]. 中国生物制品学杂志, 2011,24(12):1511-1513.
[26]宋玉财,李鹏,王彬,等.LAMP 技术在家禽 病毒病检测中的应用[J].家禽科学,2016(04): 53-55.
[27]魏晓媛,李杰峰,颜国华,等.环介导等温扩 增技术及其在鸡病诊断中的应用[J].中国畜牧 兽医文摘,2016,32(01):56-57+101.
[28]王辰雨,胡敬东,史玉颖,等. 禽流感病毒 LAMP 快速诊断方法的建立[J]. 浙江农业学报, 2014,26(03):576-580.
[29]罗思思,谢芝勋,谢丽基,等.H7 亚型和 N9 亚型禽流感病毒 RT-LAMP 可视化检测方法的 建立[J].畜牧兽医学报,2015,(07):1176-1183.
[30]彭宜,谢芝勋,郭捷,等.利用 RT-LAMP 可 视化检测技术检测 H1 亚型禽流感病毒及 N1、 N2 亚型的分型 [J]. 病毒学报,2013,29(02): 154-161.
[31]Masaki Imai,Ai Ninomiya,Harumi Minekawa, et al. Rapid diagnosis of H5N1 avian influenza virus infection by newly developed influenza H5 hemagglutinin gene-specific loop-mediated isothermal amplification method[J]. Journal of Virological Methods,2006,141(2).
[32]黄书林,吴彤,蒋菲,等. H5 亚型禽流感病 毒环介导等温扩增检测方法的建立 [J]. 农业生 物技术学报,2016,24(09):1384-1391.
[33]石霖,王秀荣,孙阮洋,等.禽流感病毒通用 型 RT-LAMP 快速检测方法的建立[J].中国预防 兽医学报,2015,37(05):383-386.
[34]Piepenburg Olaf,Williams Colin H,Stemple Derek L,et al. DNA detection using recombination proteins.[J]. PL o S Biology (Online),2006,4(7).
[35]吴耀东,徐民俊,郑文斌,等.重组酶聚合酶 扩增技术及其在动物病原快速检测中的应用 [J].中国兽医学报,2016,36(10):1797-1802.
[36]樊晓旭,赵永刚,李林,等.重组酶聚合酶扩 增技术在疾病快速检测中的研究进展[J].中国 动物检疫,2016,33(08):72-77.
[37]Kissenk-tter Jonas,Hansen S-ren,B -hlkenFascher Susanne,et al. Development of a pan-rickettsial molecular diagnostic test based on recombinase polymerase amplification assay.[J]. Analytical biochemistry,2018,544.
[38]Y.D. Wu,M.J. Xu,Q.Q. Wang,et al. Recombinase polymerase amplification (RPA) combined with lateral flow (LF) strip for detection of Toxoplasma gondii in the environment [J]. Veterinary Parasitology,2017,243.
[39]Yang Yang,Xiaodong Qin,Wei Zhang,et al. Development of an isothermal recombinase polymerase amplification assay for rapid detection of pseudorabies virus [J]. Molecular and Cellular Probes,2017,33.
[40]Nahed Yehia,Abdel-Satar Arafa,Ahmed Abd El Wahed,et al. Development of reverse transcription recombinase polymerase amplification assay for avian influenza H5N1 HA gene detection [J]. Journal of Virological Methods,2015,223.
作者: 陈淑蕾 1, 张海文 1,王学梅 1,吴科榜 1,管庆丰 1(1.海南大学热带农林学院,海口 570228)
基金项目:海南省自然科学基金项目(317030)。海南省科协青年科技英才学术创新计划项目 (201510);
通讯作者:管庆丰(1984—),男,博士,讲师,研究方向分子免疫学,邮箱 249430978@qq.com。
责任编辑:曹伟胜







