新城疫(Newcastle Disease, ND)是由新城疫病毒(NDV)引起的,严重危害我国养禽业的急性传染病。除家禽外,至少 250 种鸟类可自然或实验感染 NDV [1] 。20 世纪 60 年代和 70 年代晚期发生的 ND 大流行,都与鸽源 NDV 有关。随着我国经济的发展,赛鸽、肉鸽养殖量增长明显。据不完全统计[2] ,我省肉鸽年出栏量大于 5千万只,超过养鹅,位居家禽养殖量第三。
NDV 为副黏病毒科(Paramyxoviridae)、 副黏病毒亚科(Paramyxovirinae)、禽腮腺炎病毒属(Avulavirus)成员 [3] 。其基因组为单股负链不分节段 RNA,长约 15.2 kb[1] ,至少编码 6 种蛋白,分别为 NP、P、M、F、HN 和 L 蛋白。这其中,F 蛋白和 HN 蛋白是主要免疫原性蛋白,可诱导中和抗体的产生,并且与病毒的吸附、侵入以及毒力相关 [1,4] 。F 蛋白抗体的高低是新城疫疫苗抗体保护与否的关键因素 [5] ,因此其变异程度的高低与疫苗选择关系密切。尽管 ND 只有 1 个血清型,但基因型众多。基因型的划分方法一般利用 F 基因 47~435nt 间的序列或者 F 基因的 ORF 序列来绘制系统发育树 [6] 。由此,将 NDV 划分成不同基因型,这其中鸽群主要感染基因Ⅵ型毒株,几乎遍布世界各地,20 世纪 80~90 年代以基因Ⅵa亚型毒株为主[7, 8] ;自 20 世纪 90 年代中期以后,各地主要流行基因Ⅵb 亚型毒株 [7-10] ,但偶尔也有基因Ⅶ型毒株 [10] 。
为了了解我省鸽群 ND 流行状况,本研究对广州某养鸽场内的疑似 ND 发病样品进行了病毒分离鉴定,并对主要免疫原性相关基因进行了序列测定和分析,以期为 ND 的防制提供参考。
1、材料和方法
1.1 材料
1.1.1 样品来源
2016 年 12 月,广州市某白鸽养殖场,60 日龄左右鸽发生死亡,拉绿色稀粪。
1.1.2 SPF 鸡胚
9~11 日龄 SPF 鸡胚由广东永顺生物制药有限公司提供。
1.1.3 生化试剂
NDV 标准抗原及标准阳性血清为哈尔滨维科生物技术开发公司产品;引物由生工生物工程(上 海)股份有限公司合成;TakaraMiniBEST Viral RNA/DNA Extraction Kit 为宝生物工程(大连)有限公司产品,Hiscript Ⅱ OneStep RT-PCR Kit、DNA 分子量标准为南京诺唯赞生物科技有限公司产品,其他试剂均为分析纯。
1.2 方 法
1.2.1 病毒分离鉴定
采集发病鸽的肝脏、脾脏和肾脏,取适量研磨后按 1∶10 加入无菌生理盐水制成组织悬液。反复冻融 3 次,8 000 r/min 离心 10 min,取上清液用 0.45μm 滤器过滤后,接种 5 枚 9~11日龄SPF 鸡胚,每胚 0.2 mL。逐日观察鸡胚死亡情况,弃去 24 h 内死亡鸡胚,至 72 h 时,收获所有鸡胚尿囊液。对收获的尿囊液进行 HA 和 HI试验 [11] 。
1.2.2 F 和 HN 基因序列扩增及测定
参考文献 [12] 合成 F 和 HN 基因扩增引物。取尿囊液,参考试剂盒说明书提取 RNA,随后进行 RT-PCR。反应体系:ddH 2 O 13.5μL,2×One Step Mix 25μL,One Step Enzyme Mix2.5μL,上下游引物 (10μM) 各 2μL,RNA5μL。F 和 HN 基因扩增反应条件:50℃ 反转录30min;94℃ 预变性 5min;94℃ 30s,52℃30s,72℃ 2min,30 个循环; 最 后 72℃ 延 伸10min。经琼脂糖凝胶电泳后,阳性片段送生工生物工程(上海)股份有限公司测序。
1.2.3 F 和 HN 基因核苷酸进化树绘制及序列分析
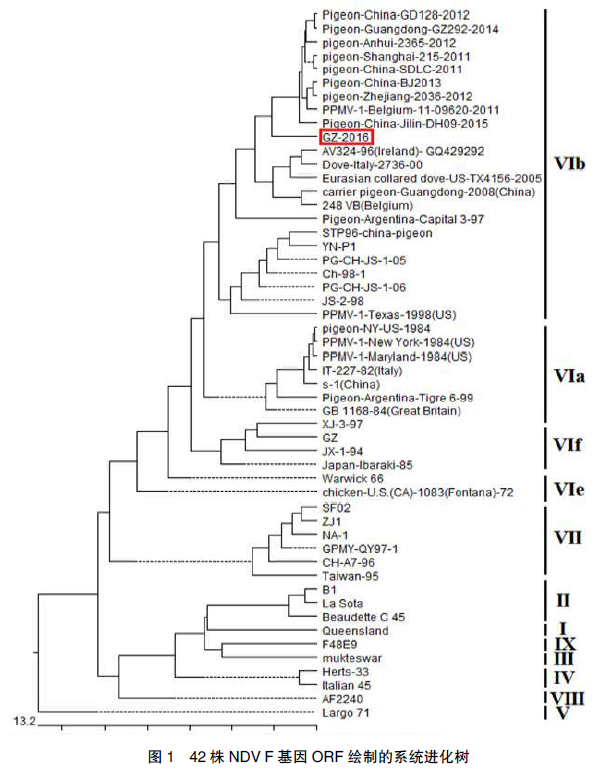
从 GenBank 下载 51 株 NDV F 基因的 ORF及 29 株 NDV HN 基因的 ORF 序列,利用DNAStar 6.0 软件包将它们与本次分离株的 F、HN 基因序列一起进行分析。使用 MegAlign 中的 Clustal V 方法,在 F 和 HN 基因核苷酸水平上绘制系统进化树。
2、结果
2.1 病毒的分离鉴定
病料接种 SPF 鸡胚后,至 72h 时,鸡胚死亡2 枚。收获鸡胚尿囊液进行 HA 和 HI 试验,结果显示,所收获的尿囊液具有血凝活性,且能够被新城疫标准阳性血清完全抑制。这表明所分离的病毒为 NDV,命名为 GZ-2016。
2.2 F 基因系统进化树及序列相似性分析
利用 MegAlign 软件(DNAStar, Version 6.0)进行毒株序列分析,结果显示,本次所分离的GZ-2016 株属于基因Ⅵb 亚型。与基因Ⅰ型(Queensland V4)和Ⅱ型(B1、La Sota)疫苗株之间 F 基因核苷酸的相似性分别为 84.3%和82.7%,氨基酸的相似性分别为 89.5%和 87.4%~87.5%。与基因Ⅵb 亚型毒株间核苷酸及氨基酸相似性均高于 90%,该毒株与我国 2010 年前的鸽源分离毒及欧洲流行毒株之间序列相似性低于 95%,但与 2011 年以后比利时和我国各地流行毒株间序列核苷酸和氨基酸相似性均大于95% 。尤其是与广东分离株 pigeon-Chi-na-GD128-2012 之间核苷酸和氨基酸序列相似性最高,分别为 96.1%和 96.6%;与基因Ⅶ型代表株(ZJ1、QY97 和 NA-1)之间核苷酸及氨基酸相似性分别为 88.6%~89.3%和 92.2%~94.0%;与我国标准强毒 F48E9 株间核苷酸及氨基酸相似性分别为 85.0%、89.9%。
2.3 HN 基因序列相似性分析
序列分析发现,GZ-2016 株的 HN 基因推导氨基酸长度为 571。与参考毒株核苷酸及推导氨基酸序列相似性比较后发现 PPMV 与基因Ⅰ型和Ⅱ型疫苗株之间 HN 基因核苷酸的相似性分别为 83.9%和 81.8%,氨基酸的相似性分别为 89.2%和 87.6%~87.8%;与基因Ⅵ型毒株间核苷酸及氨基酸相似性均高于 90.9%。其中,与基因Ⅵa 亚型核苷酸和氨基酸相似性介于90.9%~92.0%。与基因Ⅵb 亚型核苷酸和氨基酸相似性分别介于 92.9%~98.8%和 93.9%~98.8%,该毒株与我国 2010 年前的鸽源分离毒及欧洲流行毒株之间序列相似性低于 95%,但与2011 年以后比利时和我国各地流行毒株间序列核苷酸和氨基酸相似性均大于 97%。与基因Ⅶ型代表株(ZJ1、QY97 和 NA-1)之间核苷酸及氨基酸相似性分别为 84.7%~87.2%和 89.8%~92.1%;与我国标准强毒 F48E9 株间核苷酸及氨基酸相似性分别为 84.1%、88.5%。
2.4 F 蛋白和 HN 蛋白分析
序列分析发现,GZ-2016 的 F 蛋白裂解位点附近氨基酸为 112R-R-Q-K-R-F117,符合强毒株裂解位点分子特征。其 F 蛋白上的 6 个潜在糖基化位点、12 个半胱氨酸残基、7 个中和位点高度保守;其 HN 蛋白上的 6 个糖基化位点,13 个半胱氨酸残基中 12 个高度保守,第514 位半胱氨酸则为苯丙氨酸,不过该位点为非保守位点。比较重要的是,HN 蛋白第 347 位抗原位点由 E 突变为 G,这与许多基因 VI 型毒株相似。
3、讨论
NDV 毒力划分的依据是 ICPI 值和 F 蛋白裂解位点序列。当 ICPI 值 >0.7 和(或)F 蛋白裂解位点具有连续双碱性氨基酸时,可判定为强毒株 [11] 。本次分离的鸽源毒株 F 蛋白裂解位点序列为112 R-R-Q-K-R-F 117 ,符合强毒裂解位点分子特征。然而鸽源 NDV 比较特殊,一些具有强毒裂解位点特征的毒株并不一定能表现出高ICPI 值和对鸡的致病性,有时需要传代适应 [13] 。由于本次分离的毒株能导致发病鸽群死亡,结合其 F 和 HN 蛋白的序列分析结果,从分子特征上来看,该毒株为 NDV 强毒。
NDV 的进化分析过去常利用 F 基因 ORF前 374nt 的核苷酸序列 [14] ,但 Qin 等 [6] 建议利用F 基因 ORF 序列来绘制系统进化树。由于免疫压力下 NDV 存在持续的进化,因此以 F 基因ORF 序列绘制进化树,结果表明 GZ-2016 与我国近期基因Ⅵb 亚型分离株关系密切。该毒株 F基因与我国 2010 年前的鸽源分离毒及欧洲流行毒株之间序列相似性低于 95%,但与 2011 年以后比利时和我国各地流行毒株间序列核苷酸和氨基酸相似性均大于 95%,可达 96%以上;HN 基因相似性则可高达 98%以上。这说明该毒株 F 基因变异大于 HN 基因,并且鸽群中流行的毒株存在持续进化(与 2010 年前我国流行毒株间序列相似性低于 95%)。然而,我国流行毒株始终和欧洲流行株之间序列相似性较高,说明它们之间可能存在共同来源。GZ-2016 株与基因Ⅰ型、Ⅱ型疫苗株及我国标准强毒F48E9 株之间的核苷酸和氨基酸序列相似性最高仅为 90%,最低 82%,这说明,目前流行的基因Ⅵb 亚型毒株存在一定变异。分析发现,除HN 蛋白第 347 位抗原位点发生变异外,其 F和 HN 蛋白的糖基化位点、半胱氨酸残基和中和位点高度保守,说明此次分离的鸽源毒株的这些已知的重要功能区高度保守。HN 蛋白第347 位抗原位点对 HN 蛋白抗原性极其重要,是不同毒株抗原性差异的原因之一 [15] 。这说明GZ-2016 株的抗原性已经发生一定程度改变,因此有必要研究这些变化带来的影响。
尽管我国曾发现鸽源基因Ⅶ型毒株 [10] ,但近年来鸽源毒株几乎都属于基因Ⅵ型,说明这一类型毒株具有一定的宿主偏好。本研究发现,我国基因Ⅵb 亚型毒株与 10 年前的鸽群中流行的毒株之间序列差异大,这表明鸽源毒株正在持续进化。由于鸽群免疫 ND 的强度和监测力度远不及鸡群,因此持续不断监测以及合理免疫将是有效防控该病的方法之一。
参考文献
[1]Alexander DJ. Newcastle disease, other avian paramyxoviruses, and pneumovirus infections. In:Saif YM, editor. Diseases of poultry [M]. 11 th ed.2003,Iowa State University Press, Ames,LA,63-92.
[2]广东农村统计年鉴编辑委员会. 广东农村统计年鉴[M]. 中国统计出版社,2017.
[3]Mayo MA. A summary of taxonomic changes recently approved by ICTV [J]. Arch Virol. 2002,147(8):1655-1656.
[4]Kim SH, Wanasen N, Paldurai A, et al. New-castle disease virus fusion protein is the major con-tributor to protective immunity of geno-type-matched vaccine [J]. PLoS One, 2013, 8(8):e74022.
[5]Huang Z H, Panda A, Elankumaran S, et al.The hemagglutinin-neuraminidase protein of New-castle disease virus determines tropism and viru-lence[J]. J Virol, 2004,78(8): 4176-4184.
[6]Qin ZM, Tan LT, Xu HY, et al. Pathotypical characterization and molecular epidemiology of Newcastle disease virus isolates from different hosts in China from 1996 to 2005 [J]. J Clin Microbiol,2008,46(2):601-611.
[7]Aldous E W, Fuller C M, Mynn J K, et al. A molecular epidemiological investigation of isolates of the variant avian paramyxovirus type 1 virus (PPMV-1) responsible for the 1978 to present pan-zootic in pigeons [J]. Avian Pathol,2004,33 (2):258-269.
[8]Kim L M, King D J, Guzman H, et al. Biological and Phylogenetic Characterization of Pigeon Paramyxovirus Serotype 1 Circulating in Wild North American Pigeons and Doves [J]. J Clin Mi-crobio,2008,46(10):3303-3310.
[9]Mase M, Inoue T and Imada T. Genotyping of Newcastle Disease Viruses Isolated from 2001 to 2007 in Japan [J]. J Vet Med Sci,2009,71 (8):1101-1104.
[10]Liu H L, Wang Z L and Song C P. Characteri-zation of pigeon-origin Newcastle disease virus iso-lated in China[J]. Avian Dis,2006,50:636-640.
[11]刘华雷,吴艳涛,王志亮,等. 中华人民共和国国家标准. 新城疫诊断技术, GB/T 16550-2008.
[12]孙敏华, 吕殿红, 董嘉文,等. 一株鸽源新城疫病毒主要毒力基因分析 [J]. 广东畜牧兽医科技, 2010, 35(5):30-34.
[13]Kommers GD, King DJ, Seal BS, et al. Viru-lence of Pigeon-Origin Newcastle Disease Virus Isolates for Domestic Chickens [J]. Avian Dis,2001,45(4):906-921.
[14]Aldous EW, Mynn JK, Banks J, et al. A molecular epidemiological study of avian paramyx-ovirus type 1 (Newcastle disease virus) isolates by phylogenetic analysis of a partial nucleotide se-quence of the fusion protein gene [J]. Avian Pathol.2003,32(3):239-257.
[15]Hu SL, Wang TY, Liu YL, et al. Identification of a variable epitope on the Newcastle disease virus hemagglutinin-neuraminidase protein [J]. Vet Mi-crobiol,2010,140(1-2):92-97.
作者:张彦红1(华南农业大学,惠州工程职业学院,广东惠州516023)孙敏华*(广东省农业科学院动物卫生研究所广东省畜禽疫病防治研究重点实验室农业部兽用药物与诊断技术广东科学观测实验站,广州510640)
张彦红,高级讲师,华南农业大学在读博士,研究方向:禽病防治及职业教育教学。
通讯作者。广东省科技计划项目,2017A040403015 项目
责任编辑:曹伟胜







