鸭坦布苏病毒病是由鸭坦布苏病毒(Duck tembusu virus,DTMUV)引起的蛋鸭和种鸭一种急性传染病,病鸭以采食量和产蛋率急剧下降并伴有淘汰和死亡为特征 [1~2] 。该病自 2010 年首次在我国发现以来,目前在各蛋鸭场和种鸭场均有不同程度的发生,已成为危害养鸭业最严重的疾病之一。卵黄抗体是存在于禽类卵黄中的免疫球蛋白,与血清中的 IgG 相似,由于其蛋白质的物理、化学和免疫性质和哺乳动物 IgG 存在一定的差异,故这种抗体被命名为“IgY”[3] 。近几十年来国内外学者就卵黄抗体的研究和开发做了许多工作,证明 IgY 是一种高效特异的抗体。免疫鸡的卵黄可成为制备特异性免疫球蛋白最方便、最廉价的来源 [4] 。鸭坦布苏病毒病发病急,传播迅速,目前尚无有效的疫苗可用,药物治疗效果也不理想,临床上较难控制 [5] 。高免卵黄抗体的治疗效果已在长期的临床实践中得到了认可,特别在鸡传染性法氏囊病、鸭病毒性肝炎等疾病的治疗和预防效果中确实可靠。本研究拟用鸭坦布苏病毒灭活疫苗免疫高产蛋鸡,多次强化免疫后收集所产的高免鸡蛋,以制备鸭坦布苏病毒卵黄抗体。
1、材料与方法
1.1 材料
1.1.1 病毒株
鸭坦布苏病毒由华南农业大学兽医学院微生物教研室提供。
1.1.2 鸭胚
非免疫 10~11 日龄麻鸭胚,购自广州市白云区某番鸭种鸭场。
1.1.3 实验动物
140 日高产蛋鸡由广州市白云区某蛋鸡场提供,小白鼠由南方医科大学实验动物中心提供。
1.1.4 主要试剂及配制
禽用灭活疫苗佐剂购自赛彼科(上海)特殊化学品有限公司。动物组织总 RNA 提取试剂盒购自天根生化科技有限公司。
1.2 方法
1.2.1 病毒的增殖
将病毒原液接种于 10 日龄麻鸭胚,每胚 0.1 mL。之后将胚放入 37℃培养箱中孵育,每天检卵 4 次,弃 24 h 内死亡的鸭胚。收集 24~96 h 死亡的鸭胚,放入 4℃冰箱静置过夜。无菌操作采集死亡胚的尿囊液,8 000 r/min 离心 30 min。按此方法盲传到 7 代,收集所得的病毒液置于 -80℃冰箱保存。
1.2.2 DTMUV 的 RT-PCR 的鉴定
1.2.2.1 病毒 RNA 提取
参照美吉生物医药科技有限公司的动物组织 RNA 提取试剂盒进行:取 250 μL DT-MUV 液于一新的 RNase-Free离心管中,接着加入 750 μL裂解液,剧烈震荡,室温放置2~3 min,让细胞充分裂解,随后加入 200 μL 氯仿至裂解液中,剧烈震荡 15 s,室温静置3 min,4℃ 12 000 r/min 15 min。小心转移上清液至新的离心管,加入等体积 70%的乙醇,涡漩振荡 20 s。将柱子装在2 mL 收集管中,转移一半体积的混合液至柱子中,8 000 r/min30 s。倒弃滤液,柱子重新装回收集管,转移剩余混合液至柱子中。8 000 r/min 30s。倒弃滤液,柱子装回收集管,加入600 μL Buffer Rw2 (乙醇稀释)至柱子中,8 000 r/min 30s,重复上述操作一次。倒弃滤液,柱子装回收集管,10 000 r/min 离心空柱 2 min 甩干柱子基质。将柱子转移至 1.5 mL 离心管,加入 30~100 μL RNase-Freewater 至柱子膜中央,室温静置2 min,10 000 g 离心 1 min。重复上述操作一次。得到的 RNA溶液 -20℃保存或直接用于反转录。
1.2.2.2 DTMUV cDNA 的合成
下载 GenBank 中 DTMUV全基因序列,利用 Oligo 6.0 设计针对它们保守区域的特异性引物,用上述提取的病毒 RNA进行 cDNA 第一链的合成,反转录体系如表 1,20μL 总体积包括下面各组分:DTMUV-F:5’-GGCATTTCCGGACTCCAACT-3’DTMUV-R:5’-CAAGCACACGGCAATCTCAT-3’, 引物扩增长度约为 153bp。
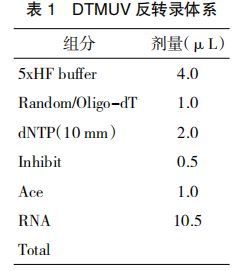
将以上各组分混匀,42℃水浴 1.5h,得到的 cDNA 直接用于 PCR。
1.2.2.3 DTMUV cDNA 的 PCR
将上述得到的 DTMUV 的cDNA 直接用于 PCR,总体系为 20μL,各组分的量如表 2。
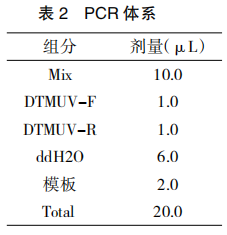
以上各组分混匀,置于PCR 扩增仪中,运行如下程序:

反应结束后,取 6μL PCR产物于 2.0%的琼脂糖凝胶进行电泳检测。
1.2.2.4 DTMUV 病毒浓缩
使用 Labscale 小型切向流超滤仪浓缩病毒。首先将所收获的 1L 第 8 代 DTMUV 病毒尿囊液 8 000 r/min 离心30 min,再将上清液倒入浓缩瓶中,开启浓缩设备,对病毒液进行浓缩。
1.2.2.5 DTMUV 灭活疫苗的制备
在上述浓缩的病毒液中加入 β 丙内脂,使其终浓度达0.025%,4℃灭活 24 h,37℃水解 2 h。灭活的病毒液与佐剂按重量比 3:7 比例置于高速搅拌机中 5 000 r/min 振荡 30 min,乳化制成灭活疫苗。
1.2.2.6 免疫蛋鸡
以制备的灭活疫苗免疫健康蛋鸡 50 只,首次免疫剂量为1 mL/ 只,间隔 14 天和 28 天后进行第二次和第三次免疫,免疫剂量均为 2 mL/ 只。3 次免疫途径均为颈背部和胸部皮下多点注射。
1.2.2.7 卵黄抗体制备
在第 3 次免疫后 2 周收集鸡蛋,分离卵黄 [6~7] 。再在粗制的卵黄抗体加入 9 倍体积酸化无菌去离子水,搅拌均匀 4℃过夜,次日离心 10 000 r/min 离心 25 min,收集上层水相,加入饱和硫酸铵使其终浓度为50%,4℃静置 1 h,5 000 r/min离心 20 min 弃上清。沉淀用等体积的灭菌生理盐水溶解,加入饱和硫酸铵,使其终浓度为30%,5 000 r/min 离心 20 min,弃上清。沉淀用等体积的 PBS(pH 7.4,0.01 mol/L)溶解,透析24 h。
2、结果与分析
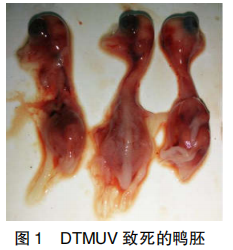
2.1 DTMUV 的繁殖与致死鸭胚的形态观察
DTMUV 第 2 代接种于鸭胚尿囊腔,37℃培养 24~96 h,胚胎发生死亡。结果如图 1,DTMUV 致死的鸭胚,全身充血,头颈部、肌肉有出血点,肝脏有坏死。
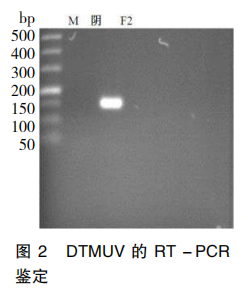
2.2 DTMUV 病毒的 RT-PCR鉴定
以设计的 DTMUV 的引物对病毒液进行 RT-PCR, 结果显示 PCR 产物中有预计大小为 153 bp 的 DNA 片段(图 2),表明所使用的病毒液含鸭坦布苏病毒。
2.3 DTMUV 灭活疫苗的安全和无菌检测结果
灭活后病毒原液与佐剂以3:7 乳化后,经物理性状外观检测显示,疫苗外观呈白色均质乳剂。剂型检查,用无菌枪头吸取疫苗滴于冷水中后,呈圆形油滴状不分散。疫苗经5 000 r/min 离心 30 min,无水相析出,较为稳定,因此所制备的疫苗剂型、稳定性及黏度均符合要求。将灭活疫苗接种于琼脂培养基上经 24 h 过夜培养观察结果无细菌生长,经腹腔注射 1 mL 灭活疫苗的 4 只小白鼠观察 4 天后并未死亡,确定该灭活疫苗安全。
2.4 卵黄抗体的物理性状
提取纯化后的卵黄抗体,经物理性状外观检测显示,卵黄抗体外观呈白色半透明状均质液体。
3、讨论
鸡卵黄中含水约 48%,蛋白质约 18%,脂肪约 31%,其中几乎所有脂肪都与蛋白质结合形成脂蛋白。α、β 和 γ 3种蛋白为水溶性蛋白,IgY 是水溶性的 γ 活性蛋白。从卵黄中获得卵黄抗体的过程包括IgY 分离提取和纯化。
IgY 分离关键是除去卵黄中高含量的脂肪及脂蛋白,以获得水溶性组分(WSF)。常见分离方法有有机物沉淀法(聚乙二醇法和硫酸葡聚糖法)、有机溶剂抽提法、天然胶法、中链脂肪酸法、去污剂分离法、水稀释法、超临界气体提取法等。本研究使用水稀释法粗提卵黄抗体,获得水溶性成分,将分离得到的卵黄液加入 9 倍体积酸化无菌去离子水(pH4.6~6.2)稀释搅拌均匀,4℃过夜,次日离心,4℃10 000 r/min 低温超速离心 25 min 去除脂类,收集上清。
IgY 提取的目的是将大量IgY 从水溶液中分离出来得卵黄抗体,主要通过盐析法,盐析破坏蛋白质的水化层,暴露疏水基因,蛋白质的可溶性随着盐浓度的增加呈对数下降,蛋白质很容易沉淀析出。常用的中性盐有硫酸铵和硫酸钠。有学者用水稀释法粗提卵黄获得水溶性成分后,用等体积PBS(pH 值 7.4)稀释,再加入饱和硫酸铵(pH 值 6.0~7.0)使硫酸铵浓度为 50%,4℃静置1 h,5 000 r/min 离心 20 min,弃上清液,再用 PBS 溶解沉淀至原 IgY 的体积,加入饱和硫酸 铵 至 33% 饱 和 度 ,5 000 r/min 离心 20 min,取沉淀,重复 2~3 次即可获得高纯度的 IgY。
为了满足不同使用目的,大多数情况下需对提取得到的卵黄抗体进一步纯化,除去其中的杂蛋白、盐、沉淀剂或其他杂质,获得高纯度的 IgY,文中主要采用透析方法。经分离、提取和纯化后的卵黄抗体外观呈白色半透明状均质液体。
参考文献
[1]赵圆圆,李传峰,朱良强.鸭产蛋下降 – 死亡综合征的临床诊断与病原的初步鉴定[J].扬州大学学报,2011(3):11-14.
[2] Cao Zhen zhen, Zhang Cun,Liu Yue huan. Tembusu Virus in Ducks,China [J]. Emerg Infect Dis,2011,17(10):18731875.
[3]HattaH,KimM,YamamotoTA.Novel isolationmethod for hen egg yolk antibody, “IgY”[J].Agric.Biol. Chem, 1990,54:2531-2535.
[4]AulisoCG,ShelokoVA. Detec-tion of microbialantobodies in chicken; immuneofluorescence with serum and egg [J]. Proc Soc Exp Bio Mod,1969,131 (4):1150-1153.
[5]朱丽萍,颜世敢.鸭坦布苏病毒研究进展 [J]. 中国预防兽医学报,2012,34(1):79-80.
[6]杨峻,王红林,温国元,等.鸭病毒性肝炎高免卵黄抗体研制与应用 [J]. 湖北农业科学,2012,51(17):3790-3793.
[7]吴博,王爽,樊兴冬,等.不同方法提取卵黄抗体效果的比较.中国兽药杂志,2012,46(6):42-45.
作者:汪小丽1邱志欣2郭霄峰1(1华南农业大学兽医学院,广州510642;2广州格雷特生物科技有限公司,广州510730)
通讯作者:郭霄峰,xfguo@scau.edu.cn
基金项目:广州市产学研协同创新重大专项 201504281643265
责任编辑:曹伟胜







