鹅细小病毒病又称小鹅瘟,是由鹅细小病毒( Goose parvovirus,GPV)引起的雏鹅和雏番鸭的一种高度接触性传染病,造成肠栓塞、纤维素性肠炎及神经症状等,具有高发病率和死亡率 [1] ,严重制约着水禽业的发展。
GPV 基因组为单链线性 DNA,5 106 bp。其基因组由左右两个开放阅读框(Open ReadingFrame,ORF)和两端的末端重复序列(Invertedterminal repeats, ITR)组成 [2] 。分析 GenBank 上各水禽细小病毒基因组序列发现,在两个 ORF 之间间隔 18bp,左侧 ORF 编码 NS1 和 NS2 两个非结构蛋白。右侧编码区编码结构蛋白,GPV共编码 3 个结构蛋白(VP1、VP2 和 VP3),VP2和 VP3 是病毒的主要衣壳蛋白,GPV 主要抗原决定簇分布在其中 [3] 。
本实验室近几年一直在对鹅细小病毒进行流行监控,2016 年广东地区一鹅场 7 日龄的雏鹅发病死亡率高达 70%,剖检发现雏鹅的肠道有栓塞现象,胰腺有白点,肝脏肿大等疑似小鹅瘟的症状。实验室采集发病雏鹅的肠、肝脏、胰腺等进行了病毒的分离鉴定,确诊为小鹅瘟,并对分离株进行了全基因序列的测定分析,以了解广东地区流行 GPV 的基因特征,又为疫苗株的选用及疾病的防治提供可靠的依据。
1、材料和方法
1.1 材料
1.1.1 病料来源
广东地区某鹅场。
1.1.2 鸭胚
购自广东地区某孵化场。
1.1.3 实验动物
购自佛山某鸭场(母源抗体较低)。
1.1.4 质粒、菌株
克隆载体 pMD18-T、Top10 感受态细胞为宝生物工程(大连)有限公司产品。
1.1.5 试剂及耗材
胰蛋白胨、酵母提取物为 OXOID 公司产品;0.22 μm 无菌滤器为 Millipore 公司产品;琼脂糖为北京百奥康生物技术有限公司产品;Gold view I 型核酸染色剂、DNA marker DL2000、DL5000,Premix TaqTM (EX TaqTM Version 2.0plus dye)、LA Taq 聚合酶 、Premix Ex Taq TM(Probe qPCR)试剂盒均为 Takara 公司产品;AxyPrepTM DNA Gel Extraction Kit、AxyPrepTMBody Fluid Viral DNA/RNA Miniprep Kit 为爱思进生物技术(杭州)有限公司产品,胎牛血清、胰蛋白酶、DMEM 细胞培养液为 GIBCO 公司产品。
1.2 方法
1.2.1 病料的处理及病毒在鹅胚上复制
将采取疑似发病鹅的肝脏、小肠等组织器官研磨,加入适量的双抗溶液,反复冻融 3 次,6 000 r/min 离心 10 min,4℃静置 4 h,然后通过尿囊腔接种法接种 12 日龄鸭胚,每胚 0.2 mL,置于 37℃孵化箱孵化,每天照胚,弃去 48 h 内死亡的胚。收集 48 h 后死亡的鸭胚尿囊液,同时观察胚体变化,并用此尿囊液在 12 日龄番鸭胚上盲传 3 代。收集尿囊液,于 -80℃保存。
1.2.2 病毒在 GEF 细胞上的复制
首先参照 2010 年版兽药典制备鸡胚成纤维细胞 SOP 标准进行 GEF 细胞的制备,使每毫升约含 1×106 个细胞,将细胞铺到 6 孔板中,每孔 2 mL,24h 生长至单层后,接种上述尿囊液,在 37℃、5% CO2 培养箱中孵育 1h 后,用 PBS洗 3 遍,加入含 2%FBS DMEM 培养基,置于37℃、5%CO2 培养箱中培养 96 h,每天观察细胞病变,在出现 80%细胞病变或 96 h 后,收集细胞及上清,于 -80℃保存。
1.2.3 小鹅瘟特异性 PCR 检测
小鹅瘟特异性检测引物参照孟繁兴 [4] ,引物序列为 GPVF:F:5,-CCAAGCTACAACAACCA-CATCTAC-3,R:5,-CTGCGGCAGGGCATAGA-CATCCGAC-3,将收取的尿囊液和细胞液按照AxyPrep 体液病毒 DNA/RNA 小量提取试剂盒说明书进行操作,参照 Premix TaqTM(LATaqTM Version2.0 plus dye)试剂盒说明书进行PCR 扩增。体系为 Primer Taq:10 滋L,上游引物:1 滋L,下游引物:0.1 滋L,ddH 2 0:6 滋L,模板:2 滋L。PCR 扩增仪中按照以下程序进行扩增:94℃预变性 4 min;94℃变性 30s,55 ℃退火 30 s,72℃延伸 40 s / 40s,共进行 30 个循环;72℃终延伸 10 min。
1.2.4 病毒动物回归
将上述收集到的致死鹅胚的尿囊液,取0.2 mL 10 4.0 EID 50 /0.2 mL 的病毒经肌肉注射 7 日龄无母源抗体的番鸭。攻毒后逐日观察并记录小鸭的精神状态、饮食、饮水情况,发病和病死情况。
1.2.5 细小病毒总 DNA 的提取
按照 AxyPrep 体液病毒 DNA/RNA 小量提取试剂盒说明书进行操作。
1.2.6 全基因引物的设计与合成
引物设计参照在 GenBank 上载的 GPV B株、GPV 06-0329 株和 MDPV GX5 株序列,由生工生物工程(上海)股份有限公司合成,序列如表 1 所示。
1.2.7 PCR 扩增
参照 Premix TaqTM (LA TaqTM Version2.0plus dye)试剂盒说明书进行 PCR 扩增。体系为PrimerTaq:20 滋L,上游引物:2 滋L,下游引物:2 滋L,ddH 2 0:12 滋L, 模板:4 滋L。PCR 扩增仪中按照以下程序进行扩增:94℃预变性 4 min;94℃变性 30 s,55 ℃退火 30 s,72℃延伸 40 s /2min,共进行 32 个循环;72℃终延伸 10 min。扩增 ITR 区和中间编码区过程中,72℃延伸的时间分别定为 40 s 和 2 min。用 1 %琼脂糖凝胶电泳,在紫外灯下切下目的条带。
1.2.8 PCR 扩增产物的回收和纯化
使用 Axygen 凝胶回收试剂盒进行 PCR 产物的回收与纯化,按说明书操作进行。
1.2.9 PCR 纯化产物与载体连接
连接反应参照 TaKaRa 公司 pMD18-TVector 使用说明进行 。连接反应体系为pMD18-T Vector:1 滋L,Solution I:5 滋L,PCR 产物:4 滋L,混匀离心后,于 16℃连接过夜。连接产物直接用于下一步转化实验。
1.2.10 连接产物转化感受态细胞
将感受态细胞从 -80℃中取出,融化后取50 滋L,加入上述的连接产物 5 滋L,轻轻混匀,冰上放置 30 min;于 42℃热休克 90 s 后迅速冰浴 10 min;加入 200 滋L LB 液体培养基,于 37℃摇床中以160 r/min 振摇培养 60 min;将慢摇后菌液均匀涂布于已预热的 LA 固体培养基中,待菌液被平板吸收后,将平板放在 37 ℃温箱中倒置培养 12~16 h。
1.2.11 阳性菌落的筛选和鉴定
从上述平板中挑取 5~10 个单克隆菌落,分开接种于 1 mL 含 LA 液体培养基中,37℃,220 r/min 振摇培养 4 h。直接用上述菌液作为PCR 模板进行菌液 PCR 鉴定,鉴定阳性的,每个基因片段选择 3 个经 PCR 检测为阳性的菌液送上海生工生物工程有限公司进行序列测定。
1.2.12 序列拼接与分析
测序结果用 DNAStar 分析软件中的 Seq-Man 进行拼接、整理,利用 MegAlign 进行列的比对分析,利用 MEGA 7.0 进行进化树的构建。
2、结果与分析
2.1 病毒分离
2.1.1 病毒在鹅胚上的分离
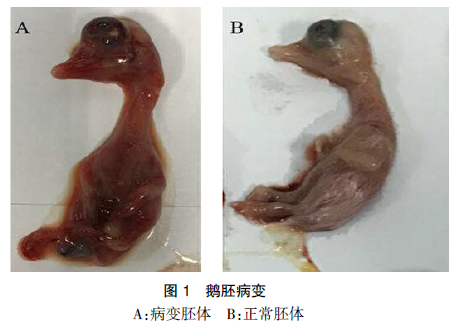
可引起第一代培养物在第六天左右出现死亡,取出胚体,可见胚体颈部四肢皮肤均有充血出血,肝脏轻度出血(见图 1)。
2.1.2 病毒在 GEF 上的分离
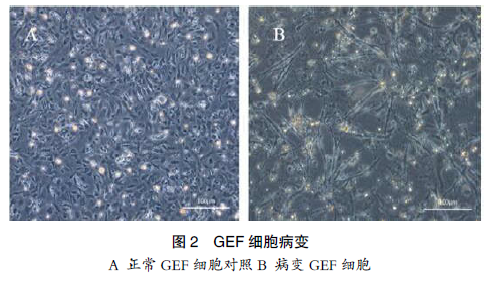
尿囊液接种 GEF 细胞,盲传 3 代,在第 4天左右细胞出现变圆,皱缩,折光度增强,最后细胞脱落细胞间隙增大(图 2)。
2.1.3 PCR 鉴定
PCR 扩增病毒基因,得到的条带与预期条带大小 375 bp 相似。
2.1.4 动物回归试验结果
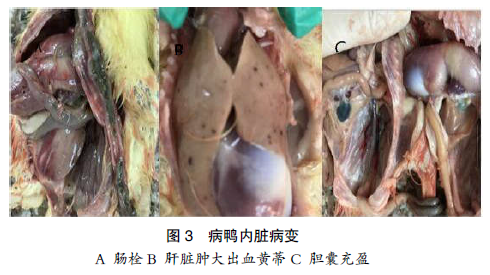
第二天开始发病,第三天出现死亡;前期发病严重,第二周后症状开始减轻,到第三周病鸭基本恢复正常;病鸭出现断毛、精神沉郁、脚软喜卧;病死鸭剖检发现肝脏肿大出血,胰腺发白出血,十二指肠糜烂,卵黄蒂附近肠段严重肠栓塞,肠出血(见图 3)。
2.2 分离株全基因序列的测定分析
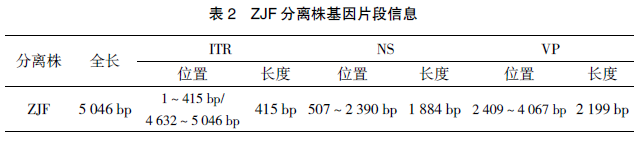
应用序列分析软件 DNAStarLasergene 7.1中的 SeqMan 对测序结果进行拼接,各毒株基因组片段具体信息如表 2 所示。
2.2.1 全基因序列同源性分析
ZJF 分离株序列全长为 5 046 bp,与江淮地区报道的鹅源 LH 株的基因全长相同,同源性也最高为 98.6%,与欧洲标准 B 株全基因同源性为 98.5%,相比在末端重复序列有碱基的缺失。与 GPV 疫苗株 GDaGPV、SYG61v 同源性较低,为 93.8%、93.9%。与番鸭小鹅瘟 SDHZ1604、JS1603 株同源性为 94.9%、95%。与番鸭细小病毒病代表株 MDPV-P1 株及 SAAS-SHNH 株同源性最低,为 81.4%,86.1%。
2.2.2 ITR 区序列分析
ZJF 分离株与 Genebank 已经发表的 11 株小鹅瘟的 ITR 序列进行比对分析,ITR 结构的同源性在 92.3%~99.3%之间,与江淮地区的LH 株、SHFX1201 株同源性最高,为 99.3%,基因片段长度一致。与欧洲标准 B 株同源性为98.1%,与其相比在 ITR 区 67~80bp(CACGT-GTTTCCGGT)及 333~347 bp(AGCATGTGAC-CGGA)处有碱基缺失。与 GDaGPV、SYG61v 株同源性为 93.0%、92.3%,也存在 67~80 bp(CACGTGTTTCCGGT)及 333~347bp(AGCAT-GTGACCGGA)处缺失。进化树显示 ZJF 株与RC16 重庆分离株、江淮地区 LH 分离株等处于同一小分支,与 GDaGPV、SYG61v 株(GPV 弱毒苗致弱前毒株)进化关系稍远,处于不同的小分支中,进化树见图 4。

2.2.3 NS 基因序列分析
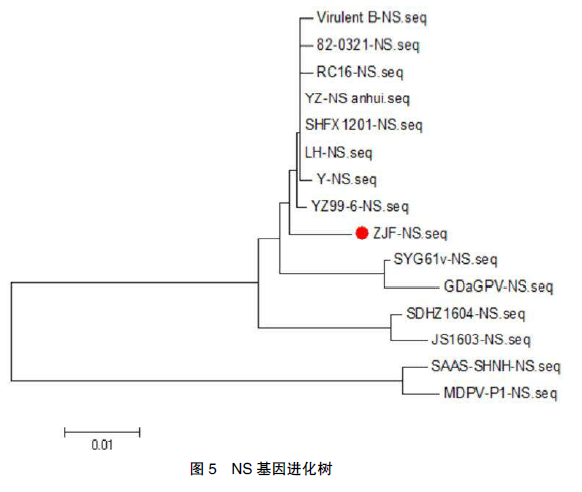
ZJF分离株 NS 基因全长为 1 884 bp,编码627 个氨基酸,与 Genebank 上已发表的 11 株GPV 的非结构蛋白 NS 相比,其核苷酸同源性在 93.5%~99.2%,氨基酸同源性在 96.7%~99%。其中 ZJF 株与江淮地区分离株 LH、SHFX1201 株、YZ 株氨基酸同源性最高,为99%,与欧洲标准株氨基酸同源性为 98.9%,与GDaGPV 株、SYG61v 株氨基酸同源性稍低,为97%、97.6%,与番鸭小鹅瘟 SDHZ1604、JS1603株核苷酸同源性分别为 95.9%、95.7%。进化树显示 ZJF 株处于经典 GPV 分支,与江淮地区分离株 LH、SHFX1201 等处于同一小分支,与GDaGPV、SYG61v 株(GPV 弱毒苗致弱前毒株)进化关系稍远,处于不同的小分支中,进化树分析见图 5。
2.2.4 VP1 基因
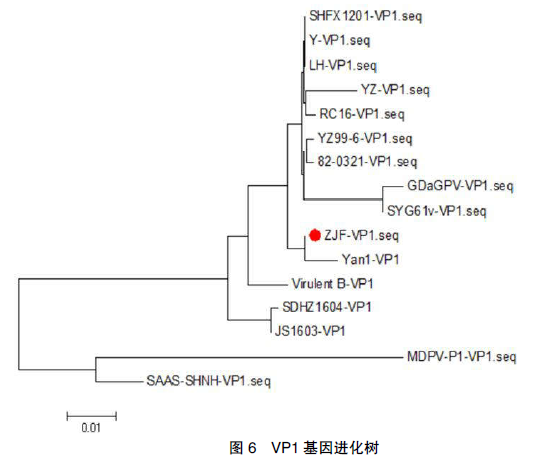
ZJF分离株的结构基因 VP1 全长为2 199bp,无任何核苷酸的缺失或插入,编码 732个氨基酸,与 Genebank 上已发表的 12 株 GPV分离株相比,核苷酸同源性为 94.5%~99.7%,氨基酸同源性为 97.3%~99.3%。与江淮地区Yan-1 株核苷酸、氨基酸同源性最高,为 99.7%(99.3%)。与江淮地区 LH、SHFX1201 株等分离株核苷酸、氨基酸同源性在 97.3%~97.9%(98.2%~99.3%)。与欧洲标准株 Virulent B 株核苷酸、氨基酸同源性为 97.5%(98%)。与GDaGPV、SYG61v 株核苷酸、氨基酸同源性较低,分别为 94.5%、94.7%(97.4%、97.8%)。与番鸭小鹅瘟 SDHZ1604、JS1603 株核苷酸、氨基酸同源性分别为 95.2%、95.3%(97.3%、97.4%)。分析显示,ZJF 分离株属于 GPV 分支,在这个大分支中又分为不同的小分支,ZJF 分离株与安徽Yan1 分离株属于同一小分支,江淮地区以 LH、SHFX1201 株为代表的分离株处于一个小分支,欧洲标准株 Virulent B 株处于一个小分支,GDaGPV、SYG61v 株处于一个小分支中,番鸭小鹅瘟 SDHZ1604、JS1603 株处于同一小分支中,提示小鹅瘟的 VP1 基因存在抗原的多样性,VP1 进化树见图 6。
3、讨论
对华南地区一鹅场送检的病料进行常规处理后,通过鹅胚、鹅胚成纤维细胞进行病毒分离、PCR 方法进行病毒鉴定结果分离到一株小鹅瘟毒株,命名为 ZJF 株。经过全基因序列的测定分析,ZJF 分离株序列全长为 5 046 bp,与江淮地区报道的 LH、SHFX1201 等基因全长基本相同,同源性也最高,为 98.2%~98.6%,与广东地区早期 GDaGPV 分离株同源性较低,为93.8%,与番鸭小鹅瘟 SDHZ1604、JS1603 株同
源性为 94.9%、95%,与番鸭细小病毒病代表株MDPV-P1 株及 SAAS-SHNH 株同源性最低,为81.4%、86.1%。ZJF ITR 分离株区全长与江淮地区 LH 株、SHFX1201 株相同,为 414bp,相较于欧洲标准株 Virulent B 株、GDaGPV 有碱基的缺失,有报道称 ITR 的长短与病毒的毒力有关,短的毒力为强毒株,长的为弱毒株,与本研究 ZJF分离株为强毒株相符合 [5] 。
ZJF 分离株 ITR 结构、NS 基因、VP1 基因进化树显示多样性,ITR 结构、NS 基因进化树分析表明 ZJF 株与重庆分离株 RC-16、江淮地区分离株 LH、SHFX1201 株等处于同一小分支中,进化关系较近。VP1 基因进化树表明,ZJF株与安徽 2011 年的 Yan-1 分离株处于同一小分支中,进化关系最近,与 LH 等株进化关系相对稍远。ZJF 分离株与广东 1978 年分离的GDaGPV 的进化关系相对较远,有可能是由于广东地区小鹅瘟毒株一直在持续地进化,也有可能与本地雏鹅苗不足,大量外购外地鹅苗,导致新的小鹅瘟毒株的引入。
国内对于水禽 GPV 全基因测序研究相对较少,导致 GPV 病毒基因分型较混乱,所以对GPV 病毒进行全基因序列的测定分析是十分有必要的。
参考文献
[1]Schettler C H. Isolation of a highly pathogenic virus from geese with hepatitis [J]. Avian Diseases,1971,15(2):323-325.
[2] 贺亦龙. 5 株水禽细小病毒基因组的克隆与遗传进化分析[D]. 东北农业大学, 2014.
[3] Tatar-Kis T, Mato T, Markos B, et al.Phyloge-netic analysis of Hungarian goose parvovirus iso-lates and vaccine strains [J]. Avian Pathology,2004,33(4):438-444.
[4]孟繁兴,董浩,胡振林,等. 鹅细小病毒吉林株的分离鉴定及其全基因序列分析[J].中国兽医杂志,2015,12(51):33-35.
[5] 吕亚楠等.小鹅瘟病毒 PCR 检测方法的建立及江淮地区小鹅瘟病毒分子流行病学调查[D].扬州大学, 2014.
作者:刘佳佳1,2 ,苏晓娜1,王占新1,2,覃健萍1,2,曾凡桂1,2,严专强1,2,鲁俊鹏 1,2*(1.广东温氏食品集团股份有限公司,广东新兴 527439;2.广东省畜禽健康养殖与环境控制企业重点实验室,广东新兴 527439;)
责任编辑:曹伟胜







