Evaluation of the Safety and Efficacy of an Infectious Bronchitis Virus Attenuated Vaccine NNA
Huang Songjian 1 , Zhang Yun 1 , Huang Mengjiao 1 , Peng Ouyang 1 , Xue Chunyi 1 , Cao Yongchang 1,*( 1 School of Life Sciences, Sun Yat-sen Uni-versity, Guangzhou 510006, PR China)
* Corresponding author
Abstract: Infectious bronchitis (IB) is an acute, highly contagious disease caused by Infectious bronchitis virus (IBV). So far, vaccination with live attenuated vaccines and inactivated vaccines is the most effective way in IBV control. In this study, different combination of vaccines include 4/91-type strain NNA wereintraocular-nasally vaccinated at 1-day-old yellow chickens and boosted 10 days later. ELISA antibody titers were tested before challenge and chickens were challenged by virulent IBV QX-type strain HSJ/2016. The result showed that the combination of Weizhiling and NNA at first vaccination and NNA alone at booster vaccination could elicit immune response remarkably and improve the protective effect against IBV infection.
Key words:Infectious bronchitis; attenuated vaccine NNA; immunogenicity
禽传染性支气管炎(Infectious bronchitis,IB) 是由禽传染性支气管炎病毒(Infectiousbronchitis virus, IBV)引起的鸡的一种急性、高接触性传染病,影响鸡的呼吸系统,生殖系统和泌尿系统等,以呼吸道症状、产蛋下降和肾脏病变等为主要特征。自 1931 年首次报道以来,该病在世界范围内大规模存在,造成严重的经济危害 [1] 。
疫苗免疫是预防 IB 的主要手段。目前大多数国家使用的减毒活疫苗株均为 Mass 型,包括Ma5、H120 和 H52,以及 Conn 疫苗株。中国使用的减毒活疫苗除 H120 和 H52 以外,还包括28/86、W93、Ma5 等疫苗株,均属于 Mass 型 [8] 。2011 年农业部批准了一种新型减毒活疫苗LDT3-A 株(型)上市。然而,由于病毒的高变异率和重组率,加上其血清型众多,且各个血清型之间只有部分或者完全没有交叉保护作用,为本病的防治带来了很大挑战。有文章报道2013-2015 年中国华南地区的 IBV 流行病学调查显示,QX 型、TW 1 型和 4/91 型占据主导位置 [9] 。NNA 是类 4/91 型传染性支气管炎弱毒疫苗,本实验室采用不同 IBV 疫苗组合免疫黄鸡,对其免疫保护效率进行了评估。
1、材料与方法
1.1 IBV 毒株、鸡胚和实验动物
NNA、LDT3、威支灵均由勃林格殷格翰公司提供。SPF 鸡胚购自广东温氏大华农生物科技有限公司 SPF 实验动物中心。QX 型华南地区流行毒株 HSJ/2016 由中山大学动物病毒学实验室分离保存。1 日龄黄鸡购自广东温氏食品集团股份有限公司。试验鸡均在广东温氏食品集团股份有限公司非雷试验场隔离器里饲养,所有的动物试验均严格按照《实验动物管理条例》等法规执行。
1.2 主要试剂与设备
PrimeScript TM One Step RT-PCR Kit Ver.2(Dye Plus) 试 剂 、PrimeScript TM RT Master Mix(Perfect Real Time)试剂、SYBR Premix Ex Taq TM(Tli RNaseH Plus)试剂均购自 Takara 公司;病毒核酸提取试剂盒购自 RaPure Viral RNA/DNA Kits 美基生物公司;禽传染性支气管炎病毒抗体检测试剂盒购自 IDEXX 公司;荧光定量 PCR仪器为 Applied Biosystems 7500 Fast Real-Time PCR System (Thermo Fisher Scientific)。
1.3 实验分组及免疫程序230 只 1 日龄黄鸡分成 7 组,分别饲养在隔离器中,采用点眼滴鼻进行免疫,免疫剂量均为 1 羽份。实验分组和免疫方法详见表 1。其中,第 6 组 35 只为攻毒阳性对照组;第 7 组 20只为阴性对照组。
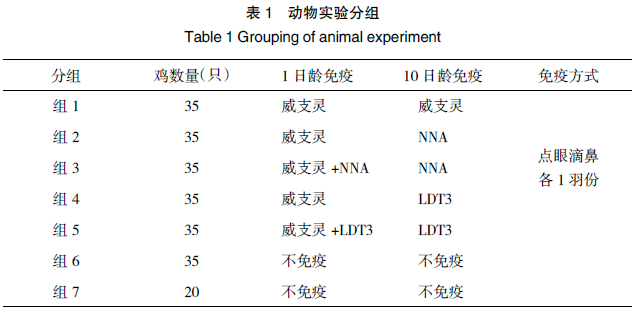
1.4 攻毒保护实验
逐日观察鸡只临床表现,任何一组非特异性死亡鸡应不超过 1 只。攻毒前,采取各组鸡只血清用 IDEXX 公司的禽传染性支气管炎病毒抗体检测试剂盒测量抗体水平。30 日龄时,除阴性对照外,各组鸡只通过点眼滴鼻的方式攻毒,攻毒毒株为 HSJ/2016(属于 QX 型),攻毒剂量为 10 5.0 EID 50 /0.2 ml/ 羽。
1.5 检测指标
1.5.1 发病率和死亡率
攻毒后,每天观察鸡只的精神状态、采食、饮水、排泄情况,是否出现呼吸道症状、啰音、以及精神萎靡、饮欲增加等 IB 典型临床病症,对鸡只进行剖检观察并进行病变计分,看是否出现喉头 / 气管出血,肾脏苍白、肿大、花斑肾等典型 IB 病变。统计发病率及死亡率。
1.5.2 病变计分
分别于攻毒后第 5 天、第 7 天和第 10 天,每组剖杀 5 只鸡,观察气管、肾脏和肺脏的病变程度,进行病变计分(0- 没有病变;1- 轻微病变;2- 中等病变;3- 严重病变)。病变判断指标为:气管有分泌物,黏膜出血;肾脏肿胀,尿酸盐沉积,花斑肾;肺脏充血肿胀。
1.5.3 病理切片
攻毒后第 5 天、第 7 天和第 10 天,每组剖杀 5 只鸡,取气管、肾脏做组织石蜡包埋切片,HE 染色以及显微镜检,最后对病理切片进行分析。
1.5.4 荧光定量 PCR 方法检测组织病毒载量
攻毒后第 5 天,每组剖杀5 只鸡,取气管、肾脏、肺脏,采用荧光定量 PCR 方法检测组织病毒拷贝数。每份病料取 0.2g 组织,加入 1 mLPBS 进行研磨,用美基生物公司的病毒核酸提取试剂盒 RaPure Viral RNA/DNA Kits 提取各个组织的总 RNA,然后反转成 cDNA,最后用Takara 公司的 SYBR Premix Ex Taq TM (TliRNaseH Plus) 测其病毒拷贝数。荧光定量 PCR引物序列和反应体系分别见表 2 和 3。
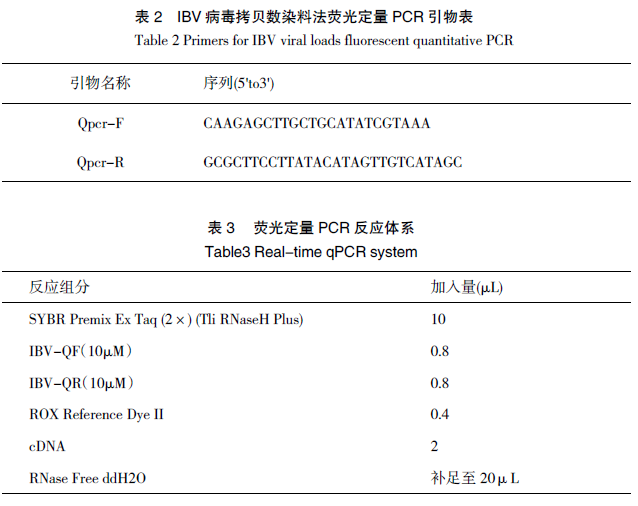
样品置于离心机短暂混匀后,使用 AppliedBiosystems 7500 Fast Real-Time PCR System(Thermo Fisher Scientific),按以下程序运行:94℃2min,95℃ 3s,60℃30s,40 个循环。
2、结果
2.1 ELISA 抗体效价
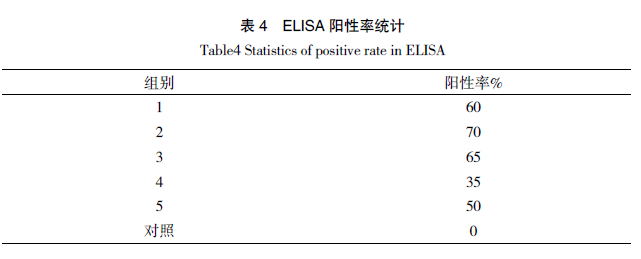
对二免后鸡只进行采血,用 IDEXX 公司的禽传染性支气管炎病毒抗体检测试剂盒测其血清抗体滴度。结果表明,各免疫组别跟对照组相比,抗体水平都有显著提高,其中第 3 组(1 日龄免疫威支灵和 NNA,10 日龄免疫 NNA)的抗体水平与对照相比有显著性增强(P<0.05)。统计各组别 ELISA 阳性率(表 4),结果显示,威支灵和 NNA 的疫苗组合诱导产生的 IBV 抗体阳性率,分别达到 65%和 70%。
2.2 病变程度以及病理组织学变化
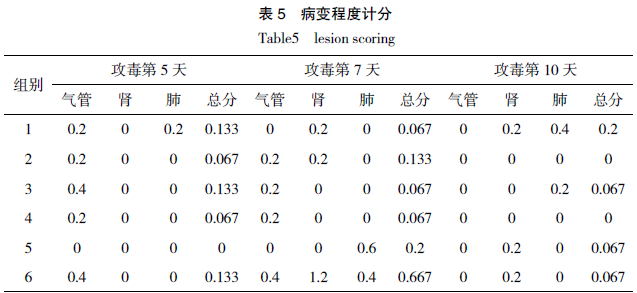
实验过程中,各组别未出现死亡情况。剖检后对脏器病变计分的结果表明(表 5),攻毒后第 7 天第 6 组(攻毒阳性组)气管、肾脏和肺脏的总病变分数为 0.667,显著高于其他组别,说明攻毒后第 7 天为 IBV 发病最严重的阶段,而经过疫苗免疫的组别只是产生很轻微的病理变化,说明免疫组相对于对照组起到明显的保护作用。其中,第 3,4 组病变程度最低。
第 1 组到第 5 组各个免疫组别,在攻毒第7 天后取其组织做病理切片分析,均未看到明显的病理变化,而第 6 组(攻毒阳性组),在攻毒后第 7 天可以看到,气管、肾和肺都有不同程度的病理变化。其中,气管组织黏膜层部分纤毛损坏脱落,黏膜下层水肿,上皮细胞排列紊乱等。肾脏组织部分肾小管上皮细胞固缩深染,胞质嗜酸性增强,疑似坏死,部分区域毛细血管瘀血。肺脏组织肺髓质广泛瘀血。部分组织病理切片图见图 3。
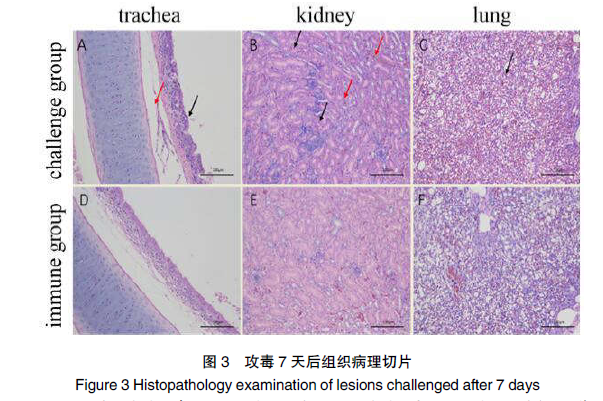
注:A-C 为空白免疫攻毒组的组织病理切片;D-F 为免疫组部分组织病理切片(A:气管组织病理切片:黏膜下层水肿(红色箭头),黏膜层上微绒毛脱落(黑色箭头),上皮细胞排列紊乱;B:肾脏组织病理切片:少量肾小管上皮细胞固缩深染,胞质嗜酸性增强(黑色箭头),疑似坏死;间质毛细血管瘀血(红色箭头);C:肺组织病理切片:髓质毛细血管广泛瘀血(黑色箭头);D-F:均为正常的组织病理切片。)
2.3 组织病毒载量
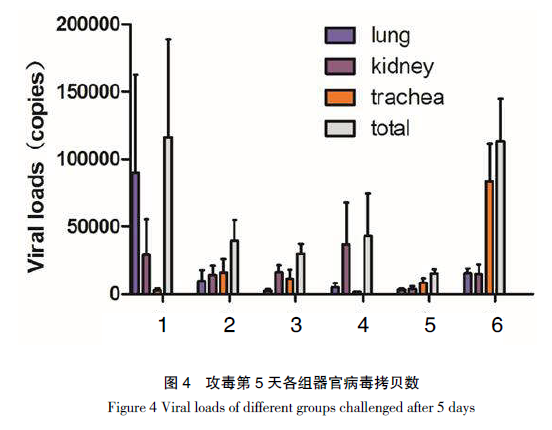
攻毒后第 5 天剖杀鸡只,测定肺、肾、气管中的病毒载量。从图 4 可以看出,攻毒第 5 天,除第 1 组外,其余各免疫组相对于第 6 组(攻毒阳性组),肺、气管以及总的病毒载量均有显著下降,特别是第 3 和第 5 组病毒载量下降尤其明显。
3、讨论
已经报道的 IBV 血清型有 30 多种;同时,IBV 的基因型、致病型以及血清型之间的相互关系还不明确 [7] 。新的 IBV 流行毒株不断出现,原有疫苗对新毒株的免疫保护效力不佳,给 IB的防控带来了很大的挑战。因此用新的流行毒株开发新的疫苗成为应对 IB 流行的一种必然选择。
NNA 是一株 4/91 型弱毒疫苗,其与目前流行的 IBV 优势毒株 QX 型 IBV 在遗传上存在一定的距离。为了评估其对黄鸡的免疫效果,我们分别于 1 日龄和 10 日龄对黄鸡进行免疫,30日龄时采用 QX 型强毒株 HSJ/2016 进行攻毒试验,同时采用广泛使用的 LDT3 弱毒疫苗作为对照。无论从抗体水平、临床表现、病理变化和攻毒后脏器的病毒载量等指标分析,NNA 弱毒疫苗对黄鸡具有较为理想的免疫效果,能提供针对流行毒株 QX 型 IBV 的攻毒保护。从攻毒后第 5 天各组器官病毒载量来看,仅用威支灵免疫的第 1 组免疫效果明显比威支灵 +NNA组合和威支灵 +LDT3 组合差。而首免采用威支灵 +NNA(或 LDT3),二免采用 NNA(或 LDT3)的免疫效果优于首免用威支灵二免用 NNA(或LDT3)的免疫程序。
结论:1 日龄采用威支灵 +NNA 联合免疫,10 日龄免疫 NNA,能使黄鸡产生良好的免疫反应,能抵抗 QX 型 IBV 流行毒株的攻击。
参考文献
[1] Jackwood MW. Review of infectious bronchitis virus around the world. Avian Dis 2012, 56 (4):634-641.
[2] Cavanagh D, Davis PJ, Cook JK, et al. Location of the amino acid differences in the S1 spike glyco-protein subunit of closely related serotypes of infec-tious bronchitis virus. Avian Pathol 1992, 21 (1):33-43.
[3] Cavanagh D, Davis PJ. Coronavirus IBV: re-moval of spike glycopolypeptide S1 by urea abol-ishes infectivity and haemagglutination but not at-tachment to cells. J Gen Virol 1986, 67:1443-1448.
[4] Promkuntod N1, van Eijndhoven RE, de Vrieze G, et al. Mapping of the receptor-binding domain and amino acids critical for attachment in the spike protein of avian coronavirus infectious bronchitis virus. Virology 2014, 448:26-32.
[5] Casais R, Dove B, Cavanagh D, et al. Recombi-nant avian infectious bronchitis virus expressing a heterologous spike gene demonstrates that the spike protein is a determinant of cell tropism. J Virol 2003, 77(16):9084-9.
[6] Bande F, Arshad SS, Bejo MH, et al. Progress and challenges toward the development of vaccines against avian infectious bronchitis. J Immunol Res 2015; 2015:424860.
[7] Sjaak De Wit JJ, Cook JKA, van der Heijden HMJF. Infectious bronchitis virus variants: a review of the history, current situation and control mea-sures [J]. Avian Pathol, 2011, 40:223-235.
[8] 刘胜旺. 我国鸡传染性支气管炎流行现状及原因分析. 中国家禽, 2010,16:5-9.
[9] Keyu Feng. Epidemiology and characterization of avian infectious bronchitis virus strains cir culat-ing in southern China during the period from 2013-2015. Scientific Reports, 2017,7:65-76.
作者:黄松健1,张芸1,黄梦姣1,彭欧阳1,张良2,薛春宜1,曹永长1,*( 1 中山大学生命科学学院,广州 5100062 勃林格殷格翰动物保健有限公司,上海200040)







