1、简介
禽流感病毒种类繁多,遗传变异频繁,表面糖蛋白层面的变异包括了抗原漂移(anti-genic drift)和抗原转变(anti-genic shift)两大类[1] 。禽流感(avian influenza virus, AIV)正是通过表面蛋白抗原的不断变异去适应宿主,从而更快地在宿主体内进行大量复制繁殖。而我国近年来出现的 H5N6 亚型HPAI 被证实是通过抗原转变的变异方式,由 H5N1 亚型AIV 与 H6N6 亚型 AIV 重组而来 [2,3] 。
根据在四川和江西等地的家禽、环境和鸟类中分离出的H5N6 亚型 AIV 的研究发现,多数都是 H5N1 亚型 AIV 和H6N6 亚型 AIV 重组而产生的一个新的亚型病毒[2] ,2014 年以来暴发的高致病性 H5N6 亚型禽流感既给养殖业带来了巨大经济损失,也影响了人类的公共卫生和健康安全 [3] 。
本研究选取 2015 年从广东野生鸟类样品中分离的 1 株H5N6 亚型 AIV 代表毒株,对其 HA 和 NA 序列进行分析,并开展对 SPF 鸡的致病性研究,以期为该病的综合防控提供科学数据。
2、材料与方法
2.1 鸡胚和试验动物
9~11 日龄 SPF 鸡胚和 6周龄的 SPF 鸡由广东大华农动物保健品股份有限公司提供。
2.2 试剂
Trizol reagent RNA 提取试剂盒、M-MLV、Ex Taq DNA 聚合酶、dNTPs、随机引物(Ran-dom primers,20 pmol/滋L)、RNA酶抑制剂 (Ribonuclease In-hibitor,RNasin)、DL2000 DNAmarker 和 pMD19-T Vector 均为 TaKaRa 公司产品;Gel Ex-traction Kit (2 000)DNA 凝胶回收试剂盒为 OMEGA 公司产品;其他化学试剂均为国产分析纯产品。
2.3 病毒的分离
每个样品中加入 5 000 IU的 双抗作用半小时后 ,取0.2mL 处理好的样品,尿囊腔接种 3 个 9~11 日龄 SPF 鸡胚,每隔 12 h 照胚 1 次,37℃恒温孵育 24~48 h(弃去 24 h内的死胚),48 h 后 4℃过夜无菌收取鸡胚尿囊液,测定 HA及交叉血凝抑制实验,收集HA 反应阳性、HI 反应中与 H5亚型标准血清呈阳性,但与H1、H3、H6、H7、H9 亚型及新城疫标准血清反应呈阴性的鸡胚尿囊液,血清阴性样品继续盲传第二代,阳性样品 -80℃冰箱保存备用。
2.4 毒株的 HA 和 NA 基因的扩增及鉴定
2.4.1 引物设计
通过 GenBank 中已录入的 H5N6 亚型 AIV 的 HA、NA序列,运用 DNAStar lesegene(version 7.1)软件和 Oligo6 软件进行基因序列分析,设计针对于 H5N6 亚型 AIV 的 HA 和NA 的鉴定引物H5-Low、H5-Up以及N6-Low、N6-Up引物(见表 1)。

2.4.2 病毒 RNA 的提取、反转录与 RT-PCR
取 500 μL 病毒尿囊液,按照说明书提取病毒总 RNA。用随机引物,按照 M-MLV 反转录酶使用说明书进行反转录获得 cDNA,以此 cDNA 为模板,用表 1 设计的 HA 和 NA的特异性引物进行 PCR 扩增,PCR 产物纯化回收后送英潍捷基测序。用 DNAStar 公司的DNAStar lesegene (version 7.1)软件对测序后结果进行拼接和分析。
2.5 鸡胚半数感染量(EID 50 )的测定
将纯化好的 AIV 按照 10倍稀释法稀释 10 -5 ~10 -10 稀释度接胚,每个稀释度各接 5 枚9~11 日龄非免疫胚,0.2 mL/枚,37℃培养,弃去 12 h 内死亡鸡胚,测定所有感染鸡胚的尿囊液血凝活性,来判断该鸡胚是否被感染 。通 过Reed-Muench 法计算病毒EID 50 滴度。
距离比值 =(高于 50%感染数 -50%)/ (高于 50%感染数- 低于 50%感染数)
LogEID 50 = 高于 50%的稀释度的对数 + 距离比值×稀释因数
2.6 毒株对 SPF 鸡的致病性试验
将 15 只 6 周龄的 SPF 鸡采取脚标编号记录,其中 6 只SPF 鸡经滴鼻点眼的方法接种0.2 mL 含有 10 6 EID 50 的病毒尿囊液,将 3 只作为同居组;另外6 只接种同样剂量无菌 PBSSPF 鸡作为空白对照组。攻毒后连续观察 14 天记录 SPF 鸡的临床症状和死亡情况。在攻毒后的第 3 天,各组随机剖检攻毒组和空白对照组各 3 只,无菌采集其盲肠扁桃体、心、气管、肺、脑、肝、脾、肾和法氏囊9 个脏器,-80℃保存,用于病毒分离和相关检测。另外在攻毒后的第 2、3、5、7、9 天定时采集口咽和泄殖腔棉拭子置于含10 000 U 双抗的 PBS 中,-80℃保存,用于病毒分离。
利用鸡胚分离法来测定病毒在 SPF 鸡体内的复制情况和感染 SPF 鸡后的排毒情况。将无菌操作获取的各组织样品称取 1g,加入 1mL 的含 5 000U 双抗的无菌 PBS 充分研磨至匀浆状,然后转移至离心管中 ,4℃ 12 000 r/min 离 心 5min。用含有 5 000 U 双抗的PBS 将各脏器匀浆上清连续10 倍稀释,每个稀释度接种 3枚 9~11 日龄非免疫鸡胚,每枚 0.1mL。采集的口咽和泄殖腔拭子分别加入含 10 000 U双抗的 PBS 后,充分震荡混匀后 12 000r/min 4℃离心 5min,取上清用含双抗的 PBS 按 10倍梯度稀释。每个稀释度分别接种 3 枚 9~11 日龄非免疫鸡胚,每枚 0.1mL。37℃培养 48 h后测定鸡胚尿囊液的血凝效价,从而测定病毒在其体内各脏器的复制情况,病毒滴度的计算按照 Reed-Muench 法。
3、结果与分析
3.1 毒株的分离鉴定结果
样品用鸡胚接种,收取鸡胚尿囊液,经血清学方法鉴定,鸡胚尿囊液的 HA 结果为阳性,HI 试验中能被 H5 标准阳性血清完全抑制,与 H1、H3、H6、H7、H9 以及新城疫标准血清反应则为阴性,鉴定为 H5亚型禽流感病毒。
3.2 毒株 HA 和 NA 基因的分子生物学鉴定结果
用 DNA 测序方法鉴定毒株,HA 和 NA 基因的检测结果分别为 H5 和 N6。根据血清学检测结果与分子生物学检测结果可知,所分离到的毒株为H5N6 亚型 AIV。
毒株的 HA 基因全长为1 776 个核苷酸,其中包含一个1 704 个核苷酸的完整ORF,能编码 568 个氨基酸。HA 基因属于 H5N1 亚型,进化分支属 2.3.4.4。ZH283 和参考毒株A/Guangzhou/39715/2014(H5N6) 亲缘关系较近,达到98.8% 。
毒株 NA 基因完整的 ORF框为 1 380 个核苷酸。ZH283都位于 Eurasian Lineage 分支的亚分支 ST192-like。与参考毒 株 A/Guangzhou/39715/2014(H5N6)有 99.1%的同源性。
3.3 鸡胚半数感染量(EID 50 )测定结果
用纯化后 H5N6 亚型禽流感毒株接种 9~11 日龄非免疫鸡胚,进行病毒扩繁, 37℃孵化培养箱培养,收取鸡胚尿囊液后,采用 HA 方法测定鸡胚是否存在病毒感染,记录各稀释度鸡胚感染数量,利用Reed-Muench 法计算病毒的EID 50 滴度。测得该毒株的EID 50 值为 10 8.75 /mL。
3.4 对 SPF 鸡的致病性试验结果
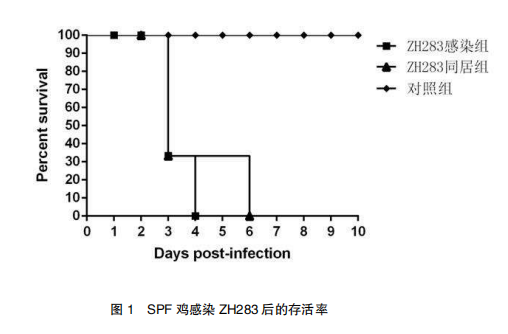
3.4.1 H5N6 亚型 AIV 感染SPF 鸡后的存活情况
ZH283 毒株以 200μL10 6 EID 50 剂量通过滴鼻点眼途径感染 SPF 鸡。连续观察 14天记录各组 SPF 鸡出现的临床症状和死亡情况(见图 1)。ZH283 感染 SPF 鸡后,感染组与同居组在 5 天后全部死亡。对照组无死亡。
3.4.2 H5N6 亚型 AIV 在 SPF鸡体内的复制情况
在攻毒后的第 3 天剖杀感染组和对照组各 3 只,ZH283感染组被检的 9 个脏器(心、气管、肺脏、脑、肝脏、肾、脾、盲肠扁桃体和法氏囊)均能检测到病毒复制,病毒滴度都达到7.83 log 10 EID 50 /g 以上,肺最高达到 10.08 log 10 EID 50 /g;对照组未检测出病毒的复制 (见表2)。说明 ZH283 在 SPF 鸡体内复制能力强。
3.4.3 SPF 鸡感染后口咽和泄殖腔的排毒情况
ZH283 感染 SPF 鸡后的第 2、3、5、7、9 天分别采集感染组、同居组以及对照组 SPF 鸡的口咽拭子和泄殖腔拭子,处理过后接种 9~11 日龄的非免鸡胚,用此来评估各组 SPF 鸡的排毒情况(见表 3)。
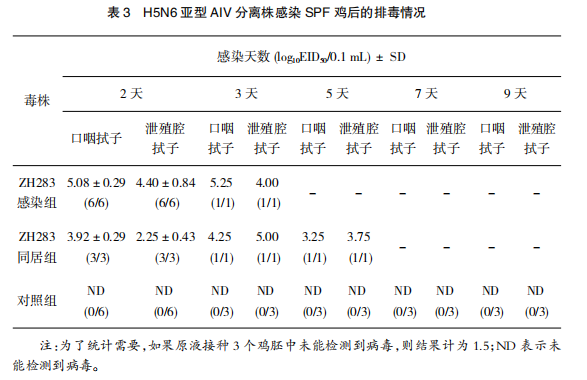
ZH283 感染组和同居组均能在口咽拭子和泄殖腔拭子中检测出排毒,感染组排毒量高达 5.25 log 10 EID 50 /0.1 mL,同居组泄殖腔拭子排毒量高达 5.00log 10 EID 50 /0.1 mL,但 5 天后全部死亡,所以 5 天后没有检测数据。对照组均未能检测到排毒情况。总体而言,ZH283 感染SPF 鸡后排毒量较高。
4、讨论
野鸟被认为是禽流感在人和动物之间循环传播的主要自然宿主,野鸟经常感染目前我们已知的各种亚型禽流感病毒 [4,5] 。野鸟和家禽感染的禽流感病毒分为高致病性禽流感病毒和低致病性禽流感病毒。大多数动物感染低致病性禽流感病毒只引起轻微的症状或无表现症状,但低致病性禽流感病毒偶尔传播给家禽或哺乳动物后会演化成高致病性禽流感病毒 [3, 6] 。而我们设计了 H5N6 亚型 AIV 在 SPF 鸡的致病性试验,表明该 H5N6 亚型 AIV 分离株对 SPF 鸡具有高致病性,可引起多种组织器官的感染并引起高效水平传播,能导致高死亡率。
多种 H5 新型重组高致病性禽流感病毒汇成 2.3.4.4 分支,自 2014 年以来呈快速型和全球型传播,多种亚型(H5N1、H5N2、H5N5、H5N6 和 H5N8)在国内的鸡、猫、猪和人中被检测出来,导致全球养禽业经济损失严重并对公共健康安全造成了严重的威胁 [3,7-10] 。因此,我们需更密切关注和掌握此流行情况,采取更为有效的应对措施,减少及避免对养禽业的经济损失。
参考文献
[1] 谭伟,徐倩,谢芝勋. 禽流感病毒研究概述 [J]. 基因组学与应用生物学,2014(01).
[2] Bi Y, Mei K, Shi W, et al. Two novel reassortants of avian in-fluenza A (H5N6) virus in China[J]. Journal of General Virology,2015, 96(5): 975-981.
[3] 黎玉莲. 2 株 H5N6 亚型禽流感病毒的序列分析和致病性研究[D]. 华南农业大学, 2016.
[4] Webster R G, Hulse-Post D J,Sturm-Ramirez K A, et al.Changing epidemiology and e-cology of highly pathogenic avian H5N1 influenza viruses[J]. Avian Diseases, 2007, 51S (1): 269-272.
[5] Fouchier R, Munster V, Wal-lensten A, et al. Characterization of a novel influenza a virus hemagglutinin subtype (H16) ob-tained from black-headed gulls[J]. Journal of Virology, 2005, 79(5): 2814-2822.
[6] Tan L, Su S, Smith D K, et al.A Combination of HA and PA Mutations Enhances Virulence in a Mouse-Adapted H6N6 In-fluenza A Virus[J]. Journal of Vi-rology, 2014, 88 (24): 14116-14125.
[7] Yu Z, Gao X, Wang T, et al.Fatal H5N6 Avian Influenza Virus Infection in a Domestic Cat and Wild Birds in China[J]. Sci-entific Reports, 2015, 5(10704).
[8] Pan M, Gao R, Lv Q, et al.Human infection with a novel,highly pathogenic avian influenza A (H5N6) virus: Virological and clinical findings[J]. Journal of in-fection, 2016, 72(1): 52-59.
[9] Yang Z, Mok C K P, Peiris J SM, et al. Human Infection with a Novel Avian Influenza A(H5N6)Virus[J]. New England Journal of Medicine, 2015, 373 (5): 487-489.
[10] Biggerstaff M, Jhung M A,Reed C, et al. Impact of medical and behavioural factors on in-fluenza-like illness, health-care-seeking, and antiviral treat-ment during the 2009 H1N1 pandemic: USA, 2009-2010 [J].Epidemiology and Infection,2014, 142(1): 114-125.̠
作者:黎玉莲, 高佩, 任涛(华南农业大学兽医学院,广州 510640)
责任编辑:曹伟胜







